
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
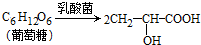
分析 实验(一):(1)根据步骤1:得到500mL原液可知,仪器A是500mL容量瓶;
(2)乳酸与氢氧化钠恰好反应时生成乳酸钠,乳酸钠呈碱性,用酚酞作指示剂,酚酞在酸性溶液中显无色,在碱性溶液中显浅红色;滴定时,当滴至待测液变色且半分钟不恢复即为滴定终点;
(3)根据数据记录表数据分析,第三组数据误差大,为错误记录,不能作为有效数据,根据题干中其余三组数据计算消耗的氢氧化钠溶液体积的平均值,乳酸的产率=$\frac{实际产量}{理论产量}$×100%,根据质量守恒,14.40g葡萄糖理论产出乳酸14.40g;
实验(二):
(4)证明乳酸为弱酸,可证明存在电离平衡、部分电离以及对应的强碱盐的溶液的酸碱性等角度设计实验;
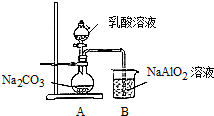
(5)①偏铝酸钠可以和少量二氧化碳反应生成氢氧化铝沉淀和碳酸钠;偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,现象是溶液出现白色浑浊;
②乳酸(2-羟基丙酸)为无色液体,与水混溶,易挥发,需排除乳酸的干扰.
解答 解:实验(一):(1)根据步骤1:过滤,将滤液转移到仪器A中,定容,得到500mL原液,说明仪器A为500mL容量瓶,
故答案为:500mL容量瓶;
(2)取20.00mL原液于锥形瓶中,加入酚酞作指示剂,用浓为0.1000mol/L的NaOH溶液滴定至终点,乳酸与氢氧化钠恰好反应时生成乳酸钠,乳酸钠呈碱性,酚酞在酸性溶液中显无色,在碱性溶液中显浅红色,所以判断已到达滴定终点为:当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色,
故答案为:当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)根据数据记录表数据分析,第三组数据误差大,为错误记录,不能作为有效数据,所以消耗的氢氧化钠溶液的体积为:$\frac{19.22+19.18+19.20}{3}$=19.20mL,20.00mL原液中,n(乳酸)=n(NaOH)=CV=0.1000mol/L×19.20×10-3L=1.92×10-3mol,实际生产乳酸的质量为:m=nM=1.92×10-3mol×$\frac{500}{20}$×90g/mol=4.32g,
根据质量守恒,14.40g葡萄糖理论产出乳酸14.40g,所以乳酸的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{4.32g}{14.4g}$×100%=30%,
故答案为:30%;
实验(二):(4)证明乳酸为弱酸,可证明存在电离平衡,取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸,或取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸,
测定该酸的钠盐溶液常温下的pH,若pH>7,说明为强碱弱酸盐,水解呈碱性,可说明为弱酸,常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸,
故答案为:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸);
(5)①偏铝酸钠可以和少量二氧化碳反应生成氢氧化铝沉淀和碳酸钠,反应的方程式为2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3,
偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,即NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3,可观察到烧杯中的现象是溶液出现白色浑浊,
故答案为:溶液出现白色浑浊;2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②乳酸(2-羟基丙酸)为无色液体,与水混溶,易挥发,需在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶,洗去二氧化碳中的乳酸,排除乳酸的干扰,
故答案为:在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.
点评 本题考查乳酸的性质实验,侧重于学生的分析能力和实验能力的考查,注意把握实验的角度和可行性的评价,明确弱电解质的判断方法,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都是无色、难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生取代反应 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 氟氯代烷(即氟利昂)是优良的制冷剂、灭火剂,需推广使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题:
Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题: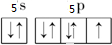 ,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;
,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
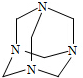
| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制备较弱酸 | 硫化氢通入硫酸铜溶液中不反应 |
| B | 压强越大,反应速率越快 | 加压,该反应2NH3?N2+3H2的正反应速率加快 |
| C | 金属性较强的金属为原电池的负极 | 铁、铜和浓硝酸形成的原电池,铁为负极 |
| D | 主族元素的最高正化合价等于主族的序数 | 氧的最高正化合价是+6 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4 可以发生 |
| C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com