
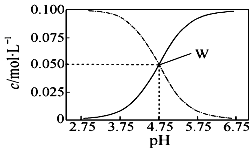
 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=3.5溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| C. | 该温度下醋酸的电离平衡常数为10-4.75 | |
| D. | 向W点所表示溶液中加入等体积的0.05 mol•L-1NaOH溶液:c(H+)=c(CH3COOH)+c(OH-) |
分析 根据图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点时c(CH3COOH)=c(CH3COO-),
A.根据图象结合溶液pH分析,pH=5.5溶液中:c(CH3COOH)<c(CH3COO-);
B.结合溶液的电荷守恒、物料守恒判断;
C.W点c(CH3COOH)=c(CH3COO-),平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$;
D.向W点所表示的溶液中加入等体积的0.05mol•L-1NaOH溶液,则溶液中的溶质是醋酸钠,醋酸钠的浓度是0.1mol/L,根据电荷守恒、物料守恒判断.
解答 解:A.根据图象知,pH=5.5溶液中:c(CH3COOH)<c(CH3COO-),故A错误;
B.pH=3.5溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol•L-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1,故B错误;
C.W点c(CH3COOH)=c(CH3COO-),平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=10-4.75mol•L-1,故C正确;
D.向W点所表示的溶液中加入等体积的0.05mol•L-1NaOH溶液,则溶液中的溶质是醋酸钠,醋酸钠的浓度是0.1mol/L,由电荷守恒可知,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得c(CH3COOH)+c(CH3COO-)=c(Na+),c(OH-)=c(CH3COOH)+c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,再结合守恒思想分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CCl4可用于鉴别溴水和碘水 | |
| B. | 用AgNO3溶液可以鉴别KCl和KI | |
| C. | 氯水久置后酸性减弱 | |
| D. | 在饱和氯水中通入H2S气体,溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 | |
| C. | 做钠的燃烧实验,可将金属钠放在坩埚里 | |
| D. | 向容量瓶转移液体时,导流用玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 测定室温下NH3•H2O的浓度及电离平衡常数Kb
测定室温下NH3•H2O的浓度及电离平衡常数Kb查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溴丙烷与足量氢氧化钠溶液混合加热,冷却后加硝酸银溶液,可检验溴元素 | |
| B. | 用新制Cu(OH)2悬浊液和氢氧化钠溶液可鉴别乙醛、乙酸和甲酸三种无色水溶液 | |
| C. | 在蔗糖溶液中加入稀硫酸,水浴加热一段时间后,加入少量新制Cu(OH)2悬浊液,加热后未出现砖红色沉淀,说明蔗糖没有水解 | |
| D. | 向蛋白质溶液中滴加CuSO4溶液,有白色固体析出,加水后不固体溶解,说明蛋白质的盐析是不可逆的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com