
【题目】高炉炼铁是现代钢铁生产的重要环节,此法工艺简单,产量大,能耗低,仍是现代炼铁的主要方法,回答下列问题:
(1)已知炼铁过程的主要反应为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1
还会发生3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=a kJ/mol;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=b kJ/mol;
FeO(s)+CO(g)=Fe(s)+ CO2(g) △H4=c kJ/mol;
则△H1=________kJ/mol(用含a、b、c的代数式表示)。
(2)高炉炼铁产生的废气(CO、CO2)有多种处理方法,反应原理如下:
①生成甲醇:CO(g)+2H2(g)![]() CH3OH(l)。一定温度下在恒容密闭容器中模拟此反应,下列化学反应速率最快的是_______________
CH3OH(l)。一定温度下在恒容密闭容器中模拟此反应,下列化学反应速率最快的是_______________
A.υ(CO)=1.2 mol/(L·min) B.υ(H2)=0.025 mol/(L·s) C.υ(CH3OH)=1 mol/(L·min)
②生成乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)。在两个容积相同的密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入原料气,CO2平衡转化率α(CO2)与温度的关系如图所示
C2H4(g)+4H2O(g)。在两个容积相同的密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入原料气,CO2平衡转化率α(CO2)与温度的关系如图所示
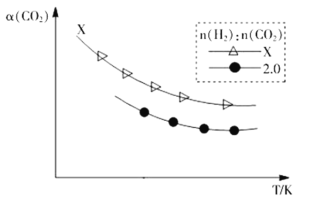
氢碳比X_____2.0(填>、<或=,下同),理由是___________________。
(3)反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),其化学平衡常数K与温度T关系如表:
CH3OH(g)+H2O(g),其化学平衡常数K与温度T关系如表:
T/℃ | 700 | 800 | 1000 | 1200 |
K | 0.6 | 1.0 | 2.3 | 3.6 |
①该反应是___________反应(填“吸热”或“放热”)。
②若某恒定温度下,向容积为1 L的恒容密闭容器中充入2 mol CO2、3 mol H2,10 min后反应达到平衡状态,测得υ (CH3OH)=0.075 mol/(L·min),则此反应条件下温度______800℃(填>、<或=)。
③若反应在1200℃进行试验,某时刻测得反应容器中各物质浓度满足关系式2c(CO2)·c3(H2)=3c(CH3OH)·c(H2O),此时反应在________向进行(填“正”或“逆”)。
【答案】![]() b+2c A > 相同温度下,氢碳比为X时二氧化碳转化率更高,则投料时H2的量更多 吸热 > 正
b+2c A > 相同温度下,氢碳比为X时二氧化碳转化率更高,则投料时H2的量更多 吸热 > 正
【解析】
(1)根据盖斯定律,将已知热化学方程式叠加,可得待求反应的热化学方程式;
(2)①转化为用同一物质表示的反应速率,且速率单位相同,速率数值越大,反应越快;
②根据浓度对CO转化率的影响分析判断X的大小;
(3)①根据温度与平衡常数的关系分析判断;
②由甲醇反应速率计算平衡时各种物质的浓度,然后计算平衡常数,并与表格数据比较,进行判断;
③把浓度关系转化为浓度商,并与1200℃的平衡常数比较,然后判断反应进行的方向。
(1)已知反应:①3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=a kJ/mol;
②Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=b kJ/mol;
③FeO(s)+CO(g)=Fe(s)+CO2(g) △H4=c kJ/mol;
根据盖斯定律,将①×![]() +②×
+②×![]() +③×2,整理可得:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=(
+③×2,整理可得:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=(![]() b+2c) kJ/mol;
b+2c) kJ/mol;
(2)①都转化为用CO的浓度变化表示反应速率,单位是mol/(L·min),然后进行比较;
A.υ(CO)=1.2 mol/(L·min);
B. υ(H2)=0.025 mol/(L·s),则根据二者反应转化关系可知υ(CO)=![]() υ(H2)=0.0125 mol/(L·s)=0.75 mol/(L·min);
υ(H2)=0.0125 mol/(L·s)=0.75 mol/(L·min);
C. υ(CH3OH)=1 mol/(L·min),则用CO表示反应速率为υ(CO)=1 mol/(L·min),
可见选项A表示的化学反应速率最快;
②在温度不变时,增大反应物H2的浓度,平衡正向移动,CO2的平衡转化率增大,即提高原料气的氢碳比,CO2的平衡转化率增大,根据图象可知:在相同温度下,氢碳比为X时二氧化碳转化率更高,则投料时H2的量更多,所以X>2;
(3)①根据表格数据可知:升高温度,化学平衡常数增大,说明升高温度,平衡正向移动,则正反应方向为吸热反应;
②在1 L容器中发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),10 min后达到平衡,此时υ(CH3OH)=0.075 mol/(L·min),则c(CH3OH)=0.075 mol/(L·min)×10 min=0.75 mol/L,根据物质反应转化关系可知平衡时c(H2O)=c(CH3OH)=0.75 mol/L,c(CO2)=2 mol/L-0.75 mol/L=1.25 mol/L,c(H2)=3 mol/L-0.75 mol/L×3=0.75 mol/L,则该温度下的化学平衡常数K=
CH3OH(g)+H2O(g),10 min后达到平衡,此时υ(CH3OH)=0.075 mol/(L·min),则c(CH3OH)=0.075 mol/(L·min)×10 min=0.75 mol/L,根据物质反应转化关系可知平衡时c(H2O)=c(CH3OH)=0.75 mol/L,c(CO2)=2 mol/L-0.75 mol/L=1.25 mol/L,c(H2)=3 mol/L-0.75 mol/L×3=0.75 mol/L,则该温度下的化学平衡常数K=![]() =1.07>1.0,大于800℃时的平衡常数,说明温度比800℃高;
=1.07>1.0,大于800℃时的平衡常数,说明温度比800℃高;
③若反应在1200℃进行试验,某时刻测得反应容器中各物质浓度满足关系式为2c(CO2)·c3(H2)=3c(CH3OH)·c(H2O),则此时浓度商Qc=![]() <3.6,比1200℃的化学平衡常数小,说明反应未达到平衡,反应正向进行。
<3.6,比1200℃的化学平衡常数小,说明反应未达到平衡,反应正向进行。


科目:高中化学 来源: 题型:
【题目】下表中各组物质不能实现如图所示转化的是
![]()
选项 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | AlCl3 | Al | Al(OH)3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。![]() 、
、![]() 常用作锂离子电池的正极材料,请回答下列问题:
常用作锂离子电池的正极材料,请回答下列问题:
(1)基态锂原子的最高能级的电子云形状是________;基态磷原子有________个未成对电子;基态铁原子核外电子排布式为________。
(2)![]() 中
中![]() 的配位数为4,配体中N的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(用元素符号表示)。
的配位数为4,配体中N的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)![]() 在水中易被还原成
在水中易被还原成![]() ,而在氨水中可稳定存在,其原因为________。
,而在氨水中可稳定存在,其原因为________。
(4)![]() 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为________(用n代表P原子数)。
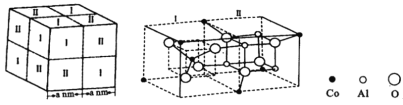
(5)钴蓝晶体结构如下图,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成。晶体中![]() 占据
占据![]() 形成的________(填“四面体空隙”或“八面体空隙”);钴蓝晶体的密度为___________
形成的________(填“四面体空隙”或“八面体空隙”);钴蓝晶体的密度为___________![]() (列出计算式,用
(列出计算式,用![]() 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g)![]() CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=______,如升高温度,K值将_____(填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是____________.
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2L恒容密闭容器中研究合成甲醇的规律。
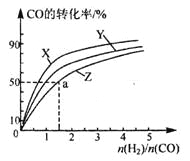
上图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是____________。由起始达到a点所需时间为5min,则H2的反应速率____________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。

①该电池工作时,正极是_____极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)+ nB![]() pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )
pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取蒸馏水如图所示:
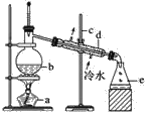
请回答下列问题:
(1)仪器b的名称是___,仪器d的名称是___。
(2)蒸馏水收集在仪器____中。
(3)仪器d的作用是___,冷水进入d仪器的方向如图所示,不能改为“上进下出”的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组欲制备三草酸合铁(Ⅲ)酸钾并用离子交换法测定其配离子的电荷,实验过程如下:
Ⅰ.三草酸合铁(Ⅲ)酸钾的制备
①称取![]() ,加数滴
,加数滴![]() ,另称取
,另称取![]() ,分别以蒸馏水溶解,将两溶液缓慢混合并加热至沸,搅拌并维持微沸约
,分别以蒸馏水溶解,将两溶液缓慢混合并加热至沸,搅拌并维持微沸约![]() 后停止加热,此时有
后停止加热,此时有![]() 晶体产生,待充分沉降后过滤,以热蒸馏水洗涤沉淀。
晶体产生,待充分沉降后过滤,以热蒸馏水洗涤沉淀。
②称取![]() ,加
,加![]() 蒸馏水,微热使其溶解,将该溶液加至已洗净的
蒸馏水,微热使其溶解,将该溶液加至已洗净的![]() 中,将盛该混合物的容器置于40℃热水中,以滴管缓慢加入约
中,将盛该混合物的容器置于40℃热水中,以滴管缓慢加入约![]() ,边加边搅拌,加完后,需检验
,边加边搅拌,加完后,需检验![]() 是否氧化彻底。
是否氧化彻底。
③在生成![]() 的同时也有
的同时也有![]() 生成,需在微沸情况下补加
生成,需在微沸情况下补加![]() 溶液,将其进一步转化为
溶液,将其进一步转化为![]() 。向所得绿色溶液中加入
。向所得绿色溶液中加入![]() 乙醇,将一小段棉线悬挂在溶液中,一端固定好,盖好烧杯,暗处放置数小时,即有
乙醇,将一小段棉线悬挂在溶液中,一端固定好,盖好烧杯,暗处放置数小时,即有![]() 析出,抽滤,向晶体上滴加少许乙醇,继续抽干,转移至表面皿上,低温干燥
析出,抽滤,向晶体上滴加少许乙醇,继续抽干,转移至表面皿上,低温干燥![]() ,称重,计算产率。
,称重,计算产率。
回答下列问题:
(1)步骤①中加硫酸的作用是___________,如何证明沉淀已洗净________________________。
(2)步骤②中,检验![]() 所用的试剂是______________,不能用酸性
所用的试剂是______________,不能用酸性![]() 溶液检验的理由是_____________________。
溶液检验的理由是_____________________。
(3)写出步骤③中![]() 转化为
转化为![]() 的化学反应方程式_____________。
的化学反应方程式_____________。
Ⅱ.离子交换法测定三草酸合铁(Ⅲ)酸钾中配离子的电荷
原理:利用离子交换树脂对某些离子具有特别的亲和力,当含有这些离子的溶液流过交换树脂时,会吸附在树脂上,树脂上原有的另一类同种电性离子会被溶液带出,从而实现离子的完全交换。
实验步骤:将准确质量的样品溶于水后,使其完全通过![]() 型离子交换树脂,样品中配离子即与氯离子实现交换。
型离子交换树脂,样品中配离子即与氯离子实现交换。
(4)若流出的交换液中![]() ,被交换配离子n(配离子)
,被交换配离子n(配离子)![]() ,则该配离子的负电荷数为___________________。
,则该配离子的负电荷数为___________________。
(5)以沉淀滴定法测定![]() :将流出液稀释至
:将流出液稀释至![]() ,取
,取![]() ,以
,以![]() 为指示剂,用
为指示剂,用![]() 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液![]() 。
。
①溶解度![]() ________
________![]() (填“大于”或“小于”)。
(填“大于”或“小于”)。
②若离子交换步骤称取的样品物质的量为![]() ,该样品中配离子所带的负电荷数为______________。
,该样品中配离子所带的负电荷数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应aA(g)+bB(g)![]() cC(g) ΔH,在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断中正确的是
cC(g) ΔH,在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断中正确的是
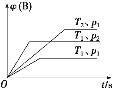
A. p1<p2,T1>T2,a+b<c,ΔH>0
B. p1<p2,T1>T2,a+b>c,ΔH>0
C. p1>p2,T1<T2,a+b<c,ΔH<0
D. p1>p2,T1<T2,a+b>c,ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol·L-1 | 5.00 | 3.50 | 2.50 | 2.50 |
A. 500 s内NO2的生成速率为3.00×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时N2O5的转化率为50%
C. 达平衡后其他条件不变,将容器体积压缩到原来的![]() ,c(N2O5)<5.00 mol·L-1
,c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com