
| A. | N O P | B. | Li Be Mg | C. | C N P | D. | Ar Cl F |
分析 设A元素的最外层电子数为x,则B、C元素的最外层电子数为x-1或x+1,则有2(x+x-1+x-1)=2×2+10+x+x-1+x-1,解之得x=$\frac{16}{3}$,不符合;若2(x+x+1+x+1)=10×2+2+x+x+1+x+1,解之得x=$\frac{20}{3}$,不符合;若2(x+x+1+x+1)=2×2+10+x+x+1+x+1,解之得x=4,符合;若2(x+x-1+x-1)=10×2+2+x+x+1+x+1,解之得x=$\frac{28}{3}$,不符合由此分析解答.
解答 解:设A元素的最外层电子数为x,则B、C元素的最外层电子数为x-1或x+1,则有2(x+x-1+x-1)=2×2+10+x+x-1+x-1,解之得x=$\frac{16}{3}$,不符合;若2(x+x+1+x+1)=10×2+2+x+x+1+x+1,解之得x=$\frac{20}{3}$,不符合;若2(x+x+1+x+1)=2×2+10+x+x+1+x+1,解之得x=4,符合;若2(x+x-1+x-1)=10×2+2+x+x+1+x+1,解之得x=$\frac{28}{3}$,所以则A、B、C三种元素分别是C N P,故选C.
点评 本题考查元素的结构和物质的推断,题目难度中等,本题关键是根据A、B同周期,B、C同主族,三种元素原子最外层电子数之和恰好为核内质子之和的$\frac{1}{2}$,分别确定元素所在的周期和主族的关系,抓住元素相邻的特点.


科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气具有还原性,可用作制冷剂 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 小苏打可与酸反应,可用作治疗胃酸过多的药剂 | |
| D. | 碳酸钠溶液显碱性,可用作锅炉除垢时CaSO4沉淀的转化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
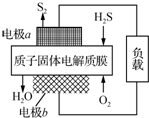 H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.右图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.右图为质子膜H2S燃料电池的示意图.下列说法正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极b上发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电路中每流过4 mol电子,电池内部释放632 kJ热能 | |
| D. | 每34 g H2S参与反应,有2 mol H+经质子膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料燃烧和工业废气中的氮氧化物是导致“雾霾天气”的原因之一 | |
| B. | 铝制餐具不宜长时间存放酸性、碱性和咸的食物 | |
| C. | 用含有铁粉的透气小袋与食品一起密封包装来防止食品氧化 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2参加反应转移电子数不一定为2NA | |
| B. | 在16g18O2中含有10NA个中子 | |
| C. | 标准状况下,22.4L HF中含2NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅥA | ⅦA | O | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
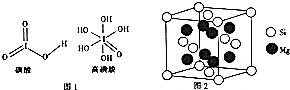 世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等.
世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com