
| A. | 肯定有CO2和SO2 | B. | 可能有HBr、CO2 | ||
| C. | 肯定没有HBr、H2S、HCl | D. | 以上结论均不正确 |
分析 加入过量氯水后得到无色透明溶液,说明混合气体中无H2S和HBr;加入盐酸酸化的BaCl2溶液,出现白色沉淀,则说明其中肯定含有SO2,氯水中含有氯离子会与硝酸银发生反应生成氯化银沉淀,不能确定是否含有HCl,无法确定是否含有CO2.
解答 解:通入氯水得无色溶液,一定无H2S、HBr,因若有这两种气体会发生反应:H2S+Cl2=HCl+S↓、HBr+Cl2=HCl+Br2,会看到浑浊或溶液颜色发生改变;
将溶液分两份一份加HCl酸化的BaCl2有白色沉淀,一定有SO2,因SO2已被氯气氧化成SO42-;另一份加HNO3酸化的AgNO3有白色沉淀,但不能确定是否含有HCl,
因第一步反应后溶液中已经存在Cl-.CO2的存在不能确定,因二氧化碳与加入试剂不反应.
A、CO2的存在不能确定,故A错误;
B、HBr一定没有,故B错误;
C、HCl的存在不能确定,故C错误;
D、故以上结论均不正确.
故选D.
点评 本题考查物质的检验和鉴别的实验方案的设计,侧重于常见气体的性质的考查,要注意加入试剂可能含有待检验的成分,不能确定此气体的存在,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2分子的结构式:O=C=O | |
| B. | S2-的结构示意图: | |
| C. | R2+离子核外有a个电子,b个中子,R原子符号为:${\;}_{a+2}^{a+b+2}$R | |
| D. | 次氯酸的电子式: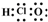 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的成分为次氯酸钙,是纯净物 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理SO2和HCl废气 | |
| D. | 干燥Cl2可使干燥有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇中的水(CaO、蒸馏) | B. | 溴乙烷中的乙醇(水、分液) | ||
| C. | 苯中的甲苯(Br2水、分液) | D. | 溴苯中的溴(NaOH溶液、分液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 全部 | C. | ②④⑤⑦ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑪ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
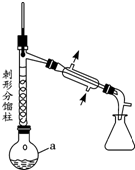 乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下:
乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下: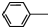 NH2+CH3COOH$\stackrel{△}{?}$
NH2+CH3COOH$\stackrel{△}{?}$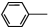 NHCOOCH3+HO
NHCOOCH3+HO| 物质 | 熔点 | 沸点 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于热水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子半径小于氧原子 |
| B | 干冰的熔沸点低 | 干冰为分子晶体 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com