
【题目】已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+C12→CO2+N2+C1-+H2O(未配平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是
A. 2 mol B. 3 mol C. 4 mol D. 6 mol
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)下列物质中属于电解质的是_________;属于非电解质的是_________;既不是电解质也不是非电解质的是________________。
①稀硫酸 ②盐酸 ③NaCl固体 ④硫酸钡 ⑤CCl4 ⑥铜
⑦NaHCO3 ⑧CO2 ⑨HCl ⑩氨气
(2)写出下列反应的离子方程式
①NaCl+AgNO3===AgCl↓+ NaNO3: _____________________________________;
②HCl+CH3COONa=== CH3COOH+NaCl:_____________________________________;
③Ba(OH)2与H2SO4两稀溶液混合 :_____________________________________;
(3)写出下列反应的化学方程式(写两个)CO![]() +2H+===CO2↑+H2O:
+2H+===CO2↑+H2O:
①_____________________________________;
②_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CO2、NO2或SO2都会导致酸雨的形成 B. 木材浸过水玻璃后,具有良好的防火性能
C. 石英坩埚、水泥、陶瓷都是硅酸盐产品 D. 氯气泄漏后,人应逆风且往低处跑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由C、H、O三种元素组成的某有机物A,在一定条件下,可以转化为有机物B、C和D、E;C又可以转化为B、A。它们的转化关系如下:

已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出下列物质的结构简式:C____, D____;
(2)C→B的反应类型为____;
(3)写出下列转化的化学方程式:
C→A________________________,
A→D________________________,
A+E→F_____________________;
(4)请写出与F具有相同官能团的所有同分异构体的结构简式(不含F):
_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往沸水中滴加几滴饱和FeCl3溶液中,制得Fe(OH)3胶体,则所得分散系( )
A. 分散质为FeCl3 B. 分散剂为Fe(OH)3
C. 分散质粒子小于1 nm D. 具有丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg,Al,Zn三种金属﹣空气电池,Al﹣空气电池的理论比能量最高
C. M﹣空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne﹣=4M(OH)n
D. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同)。

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式________,并任写一种C的主要用途 。
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): ________________________。
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系:________________________________。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为_____________________________________。
②已知常温下物质A与物质B反应生成1 mol气体C的ΔH=-57 kJ·mol-1,1 mol气体C与H2O反应生成化合物D和气体E的ΔH=-46 kJ·mol-1,写出物质A与物质B及水反应生成化合物D的热化学方程式为__________________________________________。
③有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用如图所示装置进行实验。
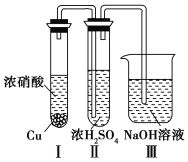
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是____________________________。
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
2CO(g) +2NO(g) ![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
已知:CO的燃烧热△H2=-283kJ/moL
N2(g) +O2(g) =2NO(g)几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | NO中氮氢键 |
键能(kJ/mol) | 945 | 498 | 630 |
求△H1__________________。
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划,在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
C(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是______________
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v(NO)=0.088mol·L-1·min-1
<>(3)氨催化氧化时会发生下述两个竞争反应I、II。催化剂常具有较强的选择性,即专一性。已知:反应I 4NH3(g)+5O2(g)![]() 4NO(g) +6H2O(g)
4NO(g) +6H2O(g)
反应 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g)
2N2(g) +6H2O(g)
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如图:

①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+3O2![]() 4N2(g) +6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
4N2(g) +6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
③由图像可判断,反应I正反应△H_______________ 0(填“>”、“<”,或“=”)
④C点比B点所产生的NO的物质的量少的主要原因_________________________。
(4)羟胺(NH2OH)的电子式_____________,羟胺是一种还原剂,可用作显像剂还原溴化银生成银单质和氮气,该反应的化学方程式为______________________________。
现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com