
【题目】原子序数依次增大的短周期主族元素X、Y、Z、W、R,其中X、Y两种元素的核电荷数之差等于它们的原子最外层电子数之和;Y、Z位于相邻主族;Z是地壳中含量最高的元素;X、W是同主族元素。上述五种元素两两间能形成四种常见的化合物甲、乙、丙、丁,这四种化合物中原子个数比如下表:
甲 | 乙 | 丙 | 丁 | |
化合物中各元素原子个数比 |
|
|
|
|
(1)写出下列元素符号:Y_____________,Z_______________,W_____________,R________________。
(2)写出下列化合物的电子式:乙_______________,丙__________________。
(3)向甲的水溶液中加入丁,有淡黄色沉淀生成,请写出反应的化学方程式:__________________。
(4)甲和乙反应能放出大量的热,同时生成两种无污染的物质,请写出该反应的化学方程式:______________________________。
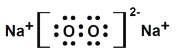
【答案】N O Na S 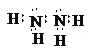
 H2O2+Na2S=2NaOH+S↓ N2H4+2H2O2=N2+4H2O
H2O2+Na2S=2NaOH+S↓ N2H4+2H2O2=N2+4H2O
【解析】
根据题目,X、Y、Z、W、R五种短周期元素,原子序数依次递增,Z为地壳中含量最多的元素,故Z为O元素;Y、Z位于相邻主族,则Y为N元素;X、Y两种元素的核电荷数之差等于它们的原子最外层电子数之和,设X元素的原子序数为x,则该原子的最外层电子数为x或x-2,当最外层电子数为x时,根据题目x+5=7-x,解得x=1,当最外层电子数为x-2时,根据题目,x-2+5=7-x,x=2,但题目要求X为主族元素,故X元素为H元素;X、W是同主族元素,则W为Na元素;根据表格,H和O两种元素形成原子个数比为1:1的化合物,则甲为H2O2,N和H两种元素形成原子个数比为1:2的化合物,则乙为N2H4,Na和O两种元素形成原子个数比为1:1的化合物,则丙为Na2O2,Na和R元素形成原子个数比为2:1的化合物,可以推断该化合物为Na2S,则R元素为S元素,据此答题。
(1)Y的元素符号为N,Z的元素符号为O,W的元素符号为Na,R的元素符号为S;
(2)乙物质的电子式为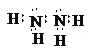 ,丙物质的电子式为
,丙物质的电子式为 ;
;
(3)向过氧化氢溶液中加入硫化钠,出现淡黄色沉淀,该沉淀为S沉淀,反应方程式为:H2O2+Na2S=2NaOH+S↓;
(4)过氧化氢和N2H4发生反应生成两种无污染的物质,这两种物质为N2和H2O,则反应方程式为:N2H4+2H2O2=N2+4H2O。


科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科技发展史上的一项重大突破。已知25℃时,合成氨反应的热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ/mol。请回答下列问题:
2NH3(g) △H=-92.4 kJ/mol。请回答下列问题:
(1)保持容器温度不变,缩小容器体积,化学反应速率_______(填“增大”或“减小”)。
(2)25℃时,取一定量的N2和H2于2 L的密闭容器中在催化剂存在下进行反应达到平衡,若增大N2的浓度,则H2的转化率____(填“增大”或“减小”);若反应达到平衡时放出的热量是92.4 kJ,则生成的NH3为______________mol。
(3)恒温恒容条件下,上述反应达到化学平衡状态的标志是________(填字母代号)。
A. N2、H2、NH3的浓度相等
B.容器内压强不再变化
C.单位时间内消耗a mol N2,同时生成2a mol NH3
(4)上述反应平衡常数的表达式为K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有__________个原子共面;
(2)金刚烷的分子式为____________________,其分子中的CH2基团有__________个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
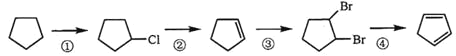
其中,反应①的产物名称是_____________,反应②的反应试剂和反应条件是_________,反应③的反应类型是_____________;
(4)已知烯烃能发生如下的反应:  ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式: ___________。
___________。
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经酸性高锰酸钾溶液氧化得羧基],写出A的一种结构简式(不考虑立体异构):________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:

回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是

实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | 亚硫酸钠 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | 高锰酸钾 | 淀粉碘化钾溶液 | 溶液会变蓝 |
C | 稀盐酸 | 碳酸钙 | 氯化钡溶液 | 有白色沉淀生成 |
D | 浓氨水 | 氧化钙 | 氯化铝溶液 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
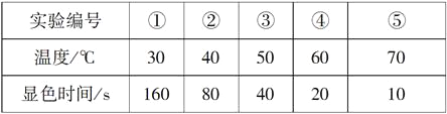
回答下列问题:
(1)该反应的离子方程式为_____________________________________。
(2)该实验的目的是__________________________________。
(3)实验试剂除了1 mol·L-1KI溶液、0.1 mol·L-1H2SO4溶液外,还需要的试剂是________,实验现象为_____________________________。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________(填字母)。
A.温度
B.试剂的浓度
C.试剂的用量(体积)
D.试剂添加的顺序
(5)由上述实验记录可得出的结论是_________________________。
(6)若要进行溶液酸性大小对反应速率的影响的探究实验,你会采取的措施是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com