
A.2H2(g)+O2(g)====2H2O(l);ΔH=-285.8 kJ/mol
B.H2(g)+![]() O2(g)====H2O(g);ΔH=-285.8 kJ/mol
O2(g)====H2O(g);ΔH=-285.8 kJ/mol
C.H2SO4(aq)+2NaOH(aq)====Na2SO4(aq)+2H2O(l);ΔH=-57.3 kJ/mol
D.H+(aq)+OH-(aq)====H2O(l);ΔH=-57.3 kJ/mol
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
| A、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | B、铅蓄电池放电时的负极和充电时的阴极均发生还原反应 | C、已知:H2(g)+I2(g)?2HI(g);△H=-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 | D、已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是________。
(2)已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是___________________________。
(3)120 ℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为________(保留两位小数)。
②若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表示式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是____________________________________。
负极的电极反应式是____________________________________。
(3)下图是一个电化学过程示意图。

①锌片上发生的电极反应式是____________________________________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化
(4)传统制备肼的方法,是以NaClO氧化NH3制得肼的稀溶液。该反应的离子方程式是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)水的电离方程式:H2O+H2O![]() H3O++OH-,若液态肼能够按照类似方式电离,请写出电离方程式:___________________________________。
H3O++OH-,若液态肼能够按照类似方式电离,请写出电离方程式:___________________________________。
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是________________________________________________。
(4)肼(N2H4)与过氧化氢、乙烷相对分子质量相近,且均为非金属氢化物,但乙烷与前两者沸点相差较大。其原因为_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省鹰潭市高三第二次模拟考试理综化学部分 题型:填空题
(13分)物质A、B、C、D为中学常见单质,其组成元素的原子序数依次减小,且其中只有三种是短周期元素,B为黄绿色气体。试根据下图中物质的相互转化关系回答下列问题。
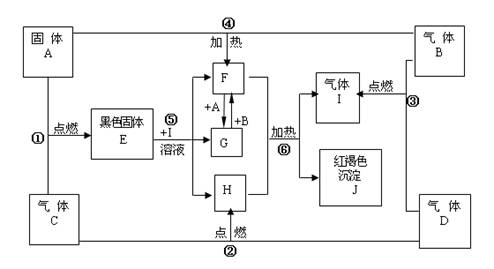
(1)A是_________
(2)在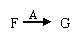 的转化中,A的作用是
;在①~⑥的反应中,不属于氧化还原反应的是
。(多填或少填无分)
的转化中,A的作用是
;在①~⑥的反应中,不属于氧化还原反应的是
。(多填或少填无分)
(3)写出A在高温下与H反应的化学反应方程式并标出电子转移的方向和数目
。
(4)写出反应⑥的化学反应方程式 。
(5)已知在101 kPa 条件下,2 mol D完全燃烧生成液态生成物放出571.6 kJ热量;请书写表示D燃烧热的热化学方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com