
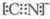 .
.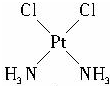 .
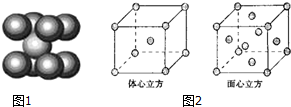
.
分析 (1)根据NF3分子中氮原子的价层电子对数及孤电子对数判断分子构型、分子的极性,水分子之间有氢键而NF3分子之间没有,据此判断熔点高低;
(2)①根据等电子体的定义分析;根据空间构型的判断方法判断;
②根据基态原子的价电子排布式书写规则书写;根据配位数的判断方法判断;根据杂化类型的判断方法判断;CN-中存在碳氮参键;
(3)A、根据离子半径与晶格能的关系分析;
B、根据最外层电子判断第一电离能的大小;
C、根据均摊法计算晶胞中原子数;
D、根据氮气的结构分析;
(4)根据物质的相似相溶原理分析;
(5)根据物质的熔沸点判断晶体类型;
(6)体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,面心立方晶胞中Fe原子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4.
解答 解:(1)NF3分子中氮原子的价层电子对数为$\frac{5+3}{2}$=4,分子中有一对孤电子对,所以其分子构型为三角锥形,碳、氮之间是极性键,其分子是极性分子,由于水分子之间有氢键而NF3分子之间没有,所以固态NF3晶体熔点比冰低,
故答案为:三角锥形;极性;极性;低;
(2)①N3-含有三个原子22个电子,与其等电子体的分子有N2O或CO2或CS2或BeCl2,N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的化学结构,二氧化碳是直线型分子,所以N3-的空间构型是直线型.
故答案为:N2O或CO2或CS2或BeCl2;直线;
②钴是27号元素,其基态原子核外电子排布式为1s22s22p63s23p63d74s2,其配位数是1+5=6;CN-中价层电子对数=1+$\frac{4+1-1×3}{2}$=2,所以采取sp杂化,原子中各有一对孤电子对,CN-与氮气互为等电子体,所以结构也相似,所以CN-电子式是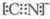 ,
,
故答案为:3d74s2;6;原子采取sp杂化,原子中各有一对孤电子对;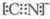 ;
;
(3)A、第一电离能(I1):N>P>S,故A正确;
B、相同电荷时,晶格能与离子的半径成反比,离子半径越大,晶格能越小,钠离子的离子半径小于钾离子的离子半径,所以NaN3的晶格能大于KN3的晶格能,故B错误;
C、钠晶胞中原子数为1+8×$\frac{1}{8}$=2,故C正确;
D、氮气分子中含有氮氮三键,键能较大,所以性质稳定,故D错误;
故答案为:AC;
(4)根据物质的相似相溶原理,极性溶质极易溶于极性溶剂,水是极性溶剂,所以此种化合物是极性溶质,其异构体的结构可用示意图表示为: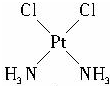 ,
,
故答案为: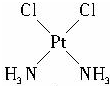 ;
;
(5)分子晶体熔沸点较低,该物质的熔沸点较低,所以为分子晶体,故答案为:分子晶体;
(6)体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,面心立方晶胞中Fe原子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,所以体心立方和面心立方晶胞中Fe原子个数之比=2:4=1:2,故答案为:1:2.
点评 本题考查了晶格能、配位数、分子的空间构型等知识点,分子的空间构型、分子中原子的杂化类型的判断是每年高考的热点,对此知识点一定掌握;元素第一电离能的规律中,要注意异常现象并会解释原因.


科目:高中化学 来源: 题型:选择题
| A. | H2O2作氧化剂 | B. | H2O2失去电子 | C. | 碘元素被还原 | D. | I-表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属单质在氧化还原反应中总是作还原剂 | |
| B. | 非金属单质在氧化还原反应中总是作氧化剂 | |
| C. | 钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以钠的还原性小于铝 | |
| D. | 金属元素被还原时一定生成金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.003 mol•(L•s)-1 | B. | v(NO)=0.08 mol•(L•s)-1 | ||
| C. | v(H2O)=0.003 mol•(L•s)-1 | D. | v(O2)=0.01 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵的电子式为 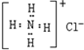 | |
| B. | 重氢负离子(${\;}_{1}^{2}$H-)的结构示意图为 | |
| C. | 次氯酸的结构式为H-Cl-O | |
| D. | 中子数为19的钙离子为${\;}_{19}^{40}$Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠和硫酸的反应 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①转化条件是氢氧化钠醇溶液、加热 | |
| B. | 产物②的名称是三氯丙烷 | |
| C. | 由丙烯转化为3-氯丙烯的反应是取代反应 | |
| D. | 三硝酸甘油酯的结构简式为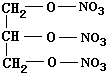 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学电池的反应本质是氧化还原反应 | |
| B. | 最早使用的化学电池是锌锰电池 | |
| C. | 最早使用的充电电池是铅蓄电池 | |
| D. | 二次电池的放电反应与充电反应可能是可逆反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com