

分析 由制备流程结合电子得失守恒和元素守恒可知,高温下发生2FeO•Cr2O3+4Na2CO3+7NaNO3$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,固体加水,SiO2、Al2O3、Fe2O3不溶于水,过滤得Na2CrO4溶液,Na2CrO4溶液中加入硫化钠,发生氧化还原反应得氢氧化铬沉淀和硫酸钠溶液,过滤得氢氧化铬固体,氢氧化铬固体灼烧得氧化铬,再利用铝热反或电解法冶炼可将氧化铬制得铬,据此答题.
解答 解:(1)根据反应前后元素的化合价变化可知,反应前铁元素的化合价从+2价升高到+3价,失去1个电子.Cr元素的化合价从+3价升高到+6价,失去3个电子.而O、Na、C的化合价均没有变化,所以根据电子的得失守恒可知,氮元素的化合价一定降低.由于铁元素共失去2个电子,Cr元素共失去12个电子.因此7个氮原子得到14个电子,则氮元素的化合价从+5价降低到+3价,所以还原产物是NaNO2,反应的离子方程式为2FeO•Cr2O3+4Na2CO3+7NaNO3$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,
故答案为:7NaNO2;
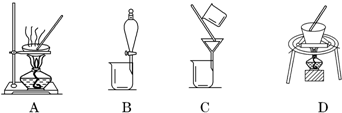
(2)过滤后的沉淀洗涤是在过滤器中完成的,所以在实验室中进行洗涤沉淀的操作是向漏斗中加蒸馏水至浸没沉淀,待液体流下,重复操作2~3次;操作②是Cr(OH)3分解生成Cr2O3,固体加热分解在坩埚中进行.A是蒸发,B是分液,C是过滤,因此答案选D,
故答案为:向漏斗中加蒸馏水至浸没沉淀,待液体流下,重复操作2~3次; D;
(3)Cr元素是高熔点金属,可以通过铝热反应或电解法冶炼,反应的方程式分别为2C2O3$\frac{\underline{\;电解\;}}{\;}$4Cr+3O2↑或2Al+C2O3$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3,
故答案为:2C2O3$\frac{\underline{\;电解\;}}{\;}$4Cr+3O2↑或2Al+C2O3$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3;
(4)①K2Cr2O7溶液显酸性且具有强氧化性,因此需要用酸式滴定管或移液管量取,
故答案为:酸式滴定管或移液管;
②K2Cr2O7在氧化还原反应中Cr元素的化合价从+6价降低到+3价,得到3个电子.而亚铁离子中铁元素的化合价从+2价升高到+3价,失去3个电子.因此根据电子得失守恒可知,去1molCr2O72-需消耗6molFe2+.由于1mol氧气做氧化剂得到4mol电子,所以molCr2O72-相当于1.5molO2,
故答案为:6;1.5.
点评 本题以物质的制备流程考查混合物分离提纯的综合应用,为高频考点,涉及流程分析、混合物分离提纯等,把握流程分析及发生的反应为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度中等.


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | 实验结论或目的 |  | |
| A | 浓盐酸 | KMnO4 | 石蕊试液 | 氯气的水溶液有酸性、漂白性 | |
| B | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| C | 硝酸 | Na2CO3溶液 | Na2SiO3溶液 | 比较硝酸、碳酸、硅酸酸性强弱 | |
| D | 溴水 | FeBr3、苯 | AgNO3溶液 | 苯和溴水能发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质铁生成 | B. | 有气泡产生、最终有白色沉淀生成 | ||
| C. | 氧化剂只有H20 | D. | 被氧化的元素有钠、铁两种元素. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
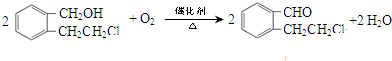
 ”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.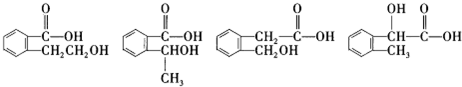 (任写两种).
(任写两种).
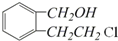 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>X | |
| B. | 元素X与M形成的化合物的空间构型可能是正四面体、直线型或平面型 | |
| C. | 将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 | |
| D. | 由Z、M两种种元素形成的化合物一定只有极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Y 与滤纸接触处有氧气生成 | B. | X 为正极,发生氧化反应 | ||
| C. | Y 为阴极,发生还原反应 | D. | X 与滤纸接触处变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com