
| A. | 加入氯化铵固体 | B. | 适当升高温度 | C. | 通入氨气 | D. | 加入少量浓盐酸 |
分析 氨水存在电离平衡NH3•H2O?NH4++OH-,要想增大NH4+的浓度,而不增大OH-的浓度,则加入的物质必须含有铵根离子或含有能和氢氧根离子反应的离子,以此解答该题.
解答 解:A.加入氯化铵固体,c(NH4+)增大,平衡逆向移动,c(OH-)减小,故A正确;
B.适当升高温度,平衡正向移动,c(NH4+)增大,c(OH-)增大,故B错误;
C.向氨水中通入氨气,c(NH4+)增大,c(OH-)增大,故C错误;
D.加入少量盐酸,盐酸和氢氧根离子反应生成水,促进氨水电离,c(NH4+)增大,c(OH-)减小,故D正确;
故选AD.
点评 本题考查弱电解质电离,为高频考点,侧重于学生的分析能力的考查,注意加入含有铵根离子或氢氧根离子的物质能抑制氨水电离,加入和铵根离子或氢氧根离子反应的物质能促进氨水电离,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 吸热反应和熵减的反应都具有自发进行的倾向 | |
| C. | 正、逆反应速率都改变,化学平衡一定发生移动 | |
| D. | 同温同压下,H2(g)+Cl2(g)?2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min 浓度/(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnS的溶解度小于PbS、CuS、CdS等硫化物的溶解度 | |
| B. | 除杂试剂MnS也可用Na2S替代 | |
| C. | MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
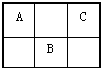 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3(s)=2KCl(s)+3O2(g)△H=-78.03 kJ•mol-1,△S=494.4 J•mol-1•K-1 | |
| B. | CO(g)=C(s,石墨)+$\frac{1}{2}$O2(g)△H=110.5 kJ•mol-1,△S=-89.4 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H=-444.3 kJ•mol-1,△S=-280.1 J•mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)=CH3COONH4 (aq)+CO2(g)+H2O(l)△H=37.30 kJ•mol-1,△S=184.0 J•mol-1•K-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当体系压强不变时反应一定达到平衡 | |
| B. | 反应放出的热量为 0.2a kJ | |
| C. | 若升高温度,v(正)加快,v(逆)减慢,平衡正向移动 | |
| D. | 在相同条件下再加入0.2mol的CO和0.2mol的 H2O(g),重新达平衡时,c(CO):c(CO2)=3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠加热可以分解,因为升高温度利于熵增的方向自发进行 | |
| B. | 在温度、压强一定的条件下,自发反应总是向△G=△H-T△S<0的方向进行 | |
| C. | 水结冰的过程不能自发进行的原因是熵减的过程,改变条件也不可能自发进行 | |
| D. | 混乱度减小的吸热反应一定不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时,左盘高,右盘低 | |
| B. | 定溶时俯视容量瓶刻度线 | |
| C. | 原容量瓶洗净后未干燥 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com