
【题目】铁的化合物在生产生活和科学实验中应用广泛:
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g)的△H=________。
2Fe(s)+3CO(g)+6H2(g)的△H=________。
②若该反应在5L的密闭容器中进行,5min后达到平衡,测得体系中固体质量减少0.96g,则该段时间内CO的平均反应速率为________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是________(选填序号)。
a.c(CH2)=c(CO) b.固体的总质量不变
c.v(CO)与v(H2)的比值不变 d.混合气体的平均相对分子质量不变
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。

试用平衡移动原理解释该曲线的变化规律________________。若700℃时测得平衡时,H2浓度为1.0mol·L-1,则CH4的平衡转化率为_________。
(2)菱铁矿的主要成分是FeCO3,实验室中可以通过FeSO4与足量NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为________________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_______________________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备,写出阳极的电极反应式_________________________________________。
【答案】 +714.6kJ/mol 0.0024mol/(L·min) bd 该反应为吸热反应,温度越高反应进行的程度越大,K越大,则pK越小 50% Fe2++2HCO3-=FeCO3↓+CO2↑+H2O(或Fe2++2HCO3-=FeCO3↓+H2CO3) K=c(H2CO3)/[c(Fe2+)·c2(HCO3-)]=Ka2/(Ksp[FeCO3]·Ka1)=4.08×106>105,所以该反应易发生 Fe-6e-+8OH-=FeO42-+4H2O
【解析】(1) ①已知:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol,②CH4(g)+ H2O(g) =CO(g)+3H2(g) △H=+206.4kJ/mol,③CO(g)+H2O(g)=CO2(g)+H2(g) △H= -41.0 kJ/mol,根据盖斯定律可知①+3×②-3×③即得Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g) △H= +714.6kJ/mol;②根据反应方程式可知,固体质量减少量即Fe2O3中氧元素的质量,即n(O)=0.06mol,则生成n(CO)=0.06mol,所以υ(CO)=
2Fe(s)+3CO(g) +6H2(g) △H= +714.6kJ/mol;②根据反应方程式可知,固体质量减少量即Fe2O3中氧元素的质量,即n(O)=0.06mol,则生成n(CO)=0.06mol,所以υ(CO)=![]() = 0.0024mol/ (L·min);③若该反应在恒温恒压容器中进行,a、当c(CH4)=c(CO)时,只是说明生成的CO浓度等于剩余CH4的浓度,但它们的速率关系如何不确定,故a不能表明反应已达平衡;b、固体的总质量不变,说明正逆反应速率相等,故b表明反应已达平衡;c、v(CO)与v(H2)的比值始终都不变,但没有指明速率的正逆方向,所以c不能表明反应已达平衡;d、由于反应前后气体的物质的量不相等,气体的质量也在变化,所以气体的质量和物质的量都不再变化时,即平均相对分子质量不变时,表明反应已达平衡,故d正确。因此本题答案是bd;④由于该反应为吸热反应,温度越高反应进行的程度越大,K越大,则pK越小;若700℃时测得平衡时,c平衡(H2)=1.0mol·L-1,则c平衡 (CO)= 0.5mol·L-1,已知pK=0,即K=1,则有
= 0.0024mol/ (L·min);③若该反应在恒温恒压容器中进行,a、当c(CH4)=c(CO)时,只是说明生成的CO浓度等于剩余CH4的浓度,但它们的速率关系如何不确定,故a不能表明反应已达平衡;b、固体的总质量不变,说明正逆反应速率相等,故b表明反应已达平衡;c、v(CO)与v(H2)的比值始终都不变,但没有指明速率的正逆方向,所以c不能表明反应已达平衡;d、由于反应前后气体的物质的量不相等,气体的质量也在变化,所以气体的质量和物质的量都不再变化时,即平均相对分子质量不变时,表明反应已达平衡,故d正确。因此本题答案是bd;④由于该反应为吸热反应,温度越高反应进行的程度越大,K越大,则pK越小;若700℃时测得平衡时,c平衡(H2)=1.0mol·L-1,则c平衡 (CO)= 0.5mol·L-1,已知pK=0,即K=1,则有![]() =1,代入即得c平衡(CH4)=0.5mol·L-1,则c起始(CH4)=1.0mol·L-1,所以CH4的平衡转化率为50%。
=1,代入即得c平衡(CH4)=0.5mol·L-1,则c起始(CH4)=1.0mol·L-1,所以CH4的平衡转化率为50%。
(2)根据叙述可知,要生成FeCO3,HCO3-就要电离出H+,则H+与另一个HCO3-反应生成CO2和H2O,所以反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O(或Fe2++2HCO3-=FeCO3↓+H2CO3); 根据反应方程式可得K=c(H2CO3)/[c(Fe2+)·c2(HCO3-)]= Ka2/[Ksp(FeCO3)·Ka1)]=4.08×106>105,所以该反应容易发生。
(3)阳极为铁,失去电子被氧化,生成FeO42-,电解质溶液中的OH-移向阳极,所以阳极反应式为Fe-6e-+8OH-=FeO42-+4H2O。


科目:高中化学 来源: 题型:
【题目】如图:已知A为单质且与盐酸反应生成B和氢气,D也为单质。根据上图回答下列问题:

(1)C的化学式为_______
(2)B+D→C的化学方程式为_________
(3)B与氨水反应的现象为__________
(4)请写出该现象对应的所有离子反应方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年中科院大连化物所包信和团队研究甲烷高效转化获重大突破。催化原理如图所示,该研究彻底摒弃了高耗能的合成气制备过程,大大缩短了工艺路线,反应过程本身实现了二氧化碳的零排放,碳原子利用效率达到100%。关于该反应的下列说法错误的是

A. 催化剂降低了反应的活化能 B. CH4→CH3+H的过程需要吸收能量
C. 该反应符合绿色化学原理 D. CH3 是稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。查阅资料知:
①Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。
③BaSO3难溶于水,可溶于稀HCl。
实验装置如图所示(省略夹持装置)
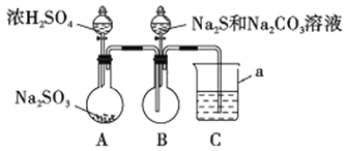
(1)仪器a的名称是_________;C中的试剂可以是______ (选填下列字母编号)。
A.稀H2SO4 B.酸性KMnO4溶液 C.饱和NaHSO3溶液 D.NaOH溶液
(2)此实验装置设计有缺陷,其改进方法是_________________________。
(3)写出B中反应的离子方程式_________________________________________。
(4)A、B中反应完后,在拆装置前,应将其中污染空气的有毒气体除去,采用的方法和具体操作是________________________________________。
(5)该法所得产品中常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,加足量BaCl2溶液,有白色沉淀生成,_______________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(6)测定产品纯度:准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2=S4O62-+2I-)
①滴定至终点时,溶液颜色的变化是_______________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 19.45 |
第四次 | 0.00 | 16.00 |
③产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10gCaCO3粉末分别加入到下列溶液中,充分搅拌,各溶液中Ca2+的浓度最小的为
A. 10mL水 B. 10mL,0.01 mol·L-1盐酸溶液
C. 10mL,0.01mol·L-1Ca(NO3)2溶液 D. 10mL,0.1 mol·L-1K2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 molCaCl2溶解于水配成2 L溶液,所得溶液物质的量浓度是( )
A. 0.5 mol/L B. 1 mol/L C. 2 mol/L D. 4 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com