
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
| A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.4moNH3参加反应失去12mol电子 |
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:单选题
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
| A.Co2O3 + 6 HCl=2CoCl2 + Cl2↑+ 3H2O |
| B.Cl2 + FeI2 = FeCl2 + I2 |
| C.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 |
| D.2Fe3+ + 2I— = 2Fe2++ I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。
(1)下列说法正确的是_________(填序号)。
A.解毒剂美蓝应该具有氧化性 B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原 D.中毒过程中血红蛋白显氧化性
(2)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O从上述反应推知________(填序号)。
A.氧化性:I2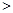 NaNO2 B.氧化性:NaNO2
NaNO2 B.氧化性:NaNO2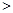 I2
I2
C.还原性:HI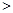 NO D.还原性:I2
NO D.还原性:I2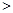 HI
HI
(3)根据上述反应,可用试纸和生活中常见的物质进行实验来鉴别NaNO2和NaCl。现供选用的物质有:①白酒 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋,进行本实验时,可以选用的物质至少有__________(填序号)。
(4)某工厂的废液中含有2%~5%的NaNO2,直接排放会造成污染。下列试剂中:①NaCl②NH4Cl ③HNO3 ④浓H2SO4,能使NaNO2转化为N2的是_______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得: SiO2 + C + N2 Si3N4 + CO
Si3N4 + CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是 。
(3)分析反应可推测碳、氮气的氧化性:C N2(填“>”“<”“=”)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是 。
| A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备 |
| B.在电子工业上制成耐高温的电的良导体 |
| C.研发氮化硅的全陶发动机替代同类型金属发动机 |
| D.氮化硅陶瓷的开发受到资源的限制,没有发展前途 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知2Al+2NaOH+2H2O 2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
| A.每生成0.3 mol H2,被还原的水分子数目为0.6 NA |
| B.当有2.7 g Al参加反应时,转移的电子数目为0.3 NA |
| C.每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2 NA |
| D.溶液中每增加0.1 mol的AlO2-,Na+的数目就增加0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在熔融KOH中大气中的氧可将铬铁矿FeCr2O4中Fe和Cr的化合价都转化为+6价,氧化 1 mol FeCr2O4在理论上需要多少摩尔氧气
| A.2mol | B.2.5mol | C.3mol | D.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)某工业废水肿含有一定量的Cr2O72-和CrO42-,现
取样该工业废水,检测其中铬的含量。
步骤I:取25. 00 mL废水,加入适后稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,滴人几滴指示剂。
步骤Ⅲ: 用o .1000 mol·L-1Na2S2O3溶液滴定(I2+2Na2 S2O3= 2NaI+Na2S4O6)
达到终点时消耗溶液24. 00 mL。
步骤Ⅳ:将上述反应后的溶液进行如下处理:反应后废液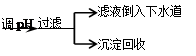
回答下列问题
(1)步骤I加入稀硫酸酸化的目的是 ;
(2)步骤Ⅱ中发生如下反应,请完善并配平离子方程式
该步骤中所加指示剂是 ;
(3)步骤Ⅲ判断滴定达到终点的现象是__ __。
(4)步骤Ⅳ在生产生活中的意义是____ (任答一条);
(5)计算工业废水中铬元素的含量是 mg/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com