
| A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 |
| B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 。下列叙述错误的是
。下列叙述错误的是
| A.电池充电时,氢元素被还原 |
| B.电池放电时,镍元素被氧化 |
| C.电池放电时,氢气在负极反应 |
| D.电池放电时,电池负极周围溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.若X为碳棒,开关K置于N处,可以减缓铁的腐蚀 |
| B.若X为锌,开关K置于N处,则X极附近溶液的颜色会变黄色 |
| C.若X为碳棒,开关K置于M处,则X电极的电极反应式为:O2+4e-+2H2O=4OH- |
| D.若X为锌,开关K置于M处,保护铁电极,则为牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该仪器工作时酒精浓度越大,则电流强度越大 |
| B.工作时处电路电子流向为X→Y |
| C.检测结束后,X极区的pH增大 |
| D.电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在熔融电解质中,O2-由负极移向正极 |
| B.电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O |
| C.通入空气的一极是负极,电极反应为:O2 + 4e- = 2O2- |
| D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2 = 4CO2 + 5H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.燃料电池将化学能转化为电能 |
| B.a是甲醇、b是氧气 |
| C.质子从M电极区穿过交换膜移向N电极区 |
| D.负极反应:CH4O - 6e- + H2O = CO2↑+ 6H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| B.电极b是正极,O2-由电极a流向电极b |
| C.电极a的反应式为:CH4+4O2--8e-===CO2+2H2O |
| D.当固体电解质中有1 mol O2-通过时,电子转移4 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0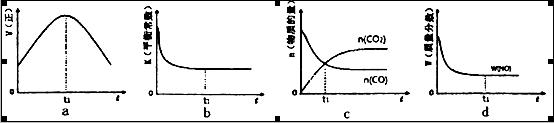
 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②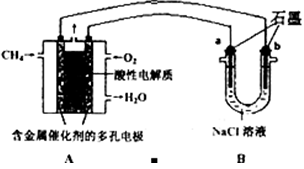
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com