
【题目】SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题.
(1)工业制硫酸过程中,SO2催化氧化的原理为: 2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.
①a、b两点对应的平衡常数K(a)K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)c(b).
②c点时,反应速率v(正)v(逆) .
(2)电化学法处理SO2 . 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为 .
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为L(已知:1个e﹣所带电量为1.6×10﹣19C).
(3)溶液法处理SO2 . 已知常温下H2SO3和H2CO3的电离常数如表所示:
电离常数 | K1 | K2 |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
常温下,将SO2缓慢通入100mL 0.2molL﹣1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为
【答案】
(1)=;>;<
(2)SO2﹣2e﹣+2H2O=4H++SO42﹣;0.014
(3)SO2+H2O+CO32﹣=HCO3﹣+HSO3﹣;c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣)
【解析】解:(1)①平衡常数随温度变化,温度不变,平衡常数不变,所以K(a)=K(b),由图象可知压强越大SO2(g)的平衡转化率(a)越大,所以b点SO2(g)的平衡转化率比a点大,则SO2浓度c(a)>c(b), 所以答案是:=;>;
②根据图象可知c点在平衡点上方,所以要达到平衡要向下移动即减小SO2(g)的平衡转化率即逆向移动,则v(正)<v(逆),
所以答案是:<;(2)①该装置是原电池,反应原理为二氧化硫、氧气和水反应生成硫酸,通入氧气的N电极是正极,原电池放电时,氢离子由负极移向正极,正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4e﹣+4H+=2H2O,负极M上,二氧化硫失电子和水反应生成硫酸,电极反应式为:SO2﹣2e﹣+2H2O=4H++SO42﹣ ,
所以答案是:SO2﹣2e﹣+2H2O=4H++SO42﹣;
②根据Q=It=2A×60s=120C,N= ![]() =
= ![]() =7.5×1020个,由
=7.5×1020个,由
SO2~~~~ | 2e﹣ |
22.4 | 2×6.02×1023 |
V | 7.5×1020 |
V= ![]() ≈0.014L,
≈0.014L,
所以答案是:0.014;(3)将当通入448mL即 ![]() =0.02molSO2缓慢通入100mL 0.2molL﹣1即0.1×0.2=0.02mol的Na2CO3溶液中时,则按1:1反应生成亚硫酸氢钠和碳酸氢钠,离子方程式为:SO2+H2O+CO32﹣=HCO3﹣+HSO3﹣;当通入896mL即
=0.02molSO2缓慢通入100mL 0.2molL﹣1即0.1×0.2=0.02mol的Na2CO3溶液中时,则按1:1反应生成亚硫酸氢钠和碳酸氢钠,离子方程式为:SO2+H2O+CO32﹣=HCO3﹣+HSO3﹣;当通入896mL即 ![]() =0.04molSO2时,则按2:1反应生成亚硫酸钠、水和二氧化碳,则所得溶液即为亚硫酸钠溶液,电离大于水解显酸性,所以溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣),
=0.04molSO2时,则按2:1反应生成亚硫酸钠、水和二氧化碳,则所得溶液即为亚硫酸钠溶液,电离大于水解显酸性,所以溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣),
所以答案是:SO2+H2O+CO32﹣=HCO3﹣+HSO3﹣;c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣).
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】如图是我国化学家近年来合成的两种聚乙炔衍生物分子的结构式. 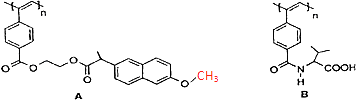
下列说法正确的是( )
A.A和B均能在一定条件下水解,且水解均生成两种产物
B.A水解生成的高分子化合物中所有碳原子一定共面
C.A和B的链节中均含有2个以上手性碳原子
D.1molA和B各与热碱液反应,均最多消耗2n mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有如图所示物质相互转换关系 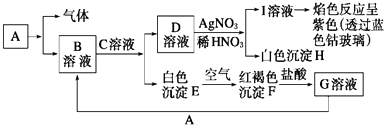
试回答:
(1)写出B的化学式 , D的化学式;
(2)写出由E转变成F的化学方程式;
(3)向G溶液中加入A的离子方程式;
向G溶液中加入铜片的离子方程式;
(4)简述B溶液中阳离子的检验方法 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD. 已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(﹣COOH)的反应.其中BAD结构简式为: 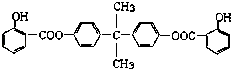
BAD的合成路线如下: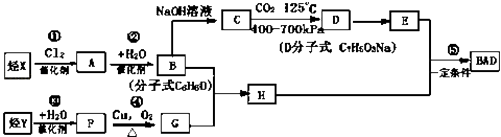
试回答下列问题:
(1)写出结构简式YD .
(2)属于加成反应的有(填数字序号) .
(3)1molBAD最多可与含molNaOH的溶液完全反应.
(4)写出方程式反应④ . F+E .
(5)E有多种同分异构体,判断符合下列要求的同分异构体数目为种. ①能发生银镜反应②遇FeCl3溶液显紫色③核磁共振氢谱图中有四个吸收峰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述不正确的是
选项 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
C | 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中 | 镁条继续燃烧,发出耀眼白光放出大量热量,生成白色固体 |
D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中, HCl 作氧化剂的是( )
A. NaOH+HCl=NaCl+H2O
B. Zn+2HCl=ZnCl2+H2↑
C. MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D. CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A. 工业上是通过电解氯化铝、氯化镁制备金属铝和镁的
B. 石油经过减压分馏主要得到C5 ~ C11的汽油制品
C. 将重油经过催化裂化可以获取汽油等产品
D. 有机玻璃是将普通硅酸盐玻璃中加入一些有机物混合而成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时10mL某气态烃与过量氧气混合,完全燃烧后的产物通过浓硫酸,再恢复到室温,气体体积减少了30mL,剩余气体再通过苛性钠溶液,体积又减少了30mL.求气态烃的分子式及结构简式.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com