
| A. | 浓H2SO4、NaOH-腐蚀品 | B. | 酒精-易燃气体 | ||
| C. | KMnO4-氧化剂 | D. | 白磷-易燃固体 |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 1 mol该化合物和足量的钠反应生成1 mol H2 | |
| C. | 能与溴发生取代反应和加成反应 | |
| D. | 1 mol该化合物最多与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 反应物的总能量比生成物的总能量大 | |
| C. | 氢氧化钠与盐酸的反应属于吸热反应 | |
| D. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1(b-2a)mol•L-1 | B. | 10(2a-b)mol•L-1 | C. | 10(b-a)mol•L-1 | D. | 10(b-2a)mol•L -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
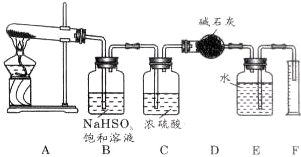
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com