
【题目】X、Y、Z是一种短周期元索,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生右下图转化关系.其中R为10电子分子,是一种常见的无机溶剂。下列说法中不正确的是
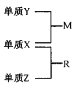
A. X元素位于周期表中第16列
B. X、Y、Z元素两两之间均能形成原子个数比为l:1的化合物
C. X、Y、Z元素形成的单质均具有强还原性
D. R的沸点高于M的沸点
科目:高中化学 来源: 题型:
【题目】
(1)配制100 mL 0.10 mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→___ ___(冷却后)→洗涤(并将洗涤液移入容量瓶)→___ ___→___ ___→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量________g氢氧化钠固体所需仪器有:托盘天平(带砝码、镊子)、________、________。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用已配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___________________________________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为_____________(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
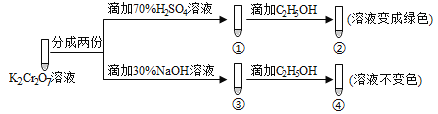
结合实验,下列说法正确的是
A. ①中溶液变黄,③中溶液橙色加深
B. 上述可逆反应的平衡常数:①<③
C. K2Cr2O7溶液的氧化性在酸性条件下更强
D. 若向④中加入70%H2S04溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度均为0.1mol·L-1的Na0H 溶液和盐酸分别滴定体积均为20mL、浓度均为0.1mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是

A. HA为弱酸,BOH为强碱
B. a点时,溶液中粒子浓度存在关系:c(B+)>c(Cl-)>c(OH-)>c(BOH)
C. b点时两种协液中水的电离程度相同.且V=20
D. c、d两点溶液混合后微粒之间存在关系:c(H+)= c(OH-)+c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,不正确的是
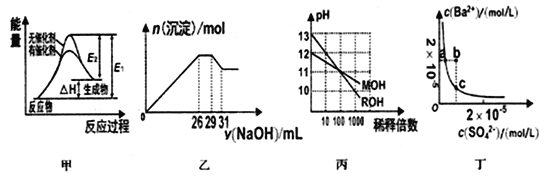
A. 若用甲表示某可逆反应的能量变化,说明催化剂能改变正、逆反应的活化能
B. 图乙表示在含Mg2+、Al3+、NH4+、Cl-的溶液中,加入一定浓度NaOH溶液时生成沉淀的图像,由图可得原溶液中,n(Mg2+):n(Al3+):n(NH4+)=10:2:3
C. 图丙表示MOH和ROH两种一元酸的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
D. 图丁表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二锰(Mn2O3)在现代工业上位用广泛,在锂离子电池的制备中有重要的作用。 用软锰矿 (主要成分为MnO2)和硫锰矿(主要成分为MnS)制备高纯度Mn2O3的工艺流程如图所示。

(1) 反应①中会生成一种非金属单质,则该非金属单质是___________,该反应的还原剂是__________。(填化学式)
(2) 操作X为蒸发浓缩、_____________、过滤、洗涤烘干。在洗涤操作中,常用酒精洗涤MnSO4 H2O晶体,主要目的是______________。
(3) Mn2O3与MnO2类似,加热时也能与浓盐酸反应放出Cl2,该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从人类健康或生活实际的角度考虑,下列叙述不正确的是( )
A.常用铁锅炒菜比常用铝锅好
B.氯气泄漏后应顺风向低处跑
C.用Na2O2做呼吸面具的供氧剂
D.食用“加碘”食盐有利于健康
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com