
| A. | 电子层数 | B. | 原子量 | C. | 次外层电子数 | D. | 最外层电子数 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
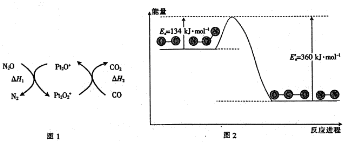
| A. | 由图1可知:△H1=△H+△H2 | |
| B. | 由图2可知△H=-226 kJ/mol | |
| C. | 为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+ | |
| D. | 由图2可知该反应正反应的活化能大于逆反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 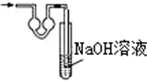 | B. | 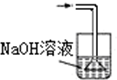 | C. | 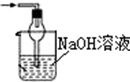 | D. | 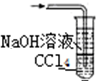 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
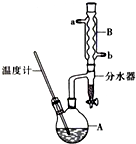 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:| 相对分子质量 | 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常元素的化合价与其原子的质量数有密切的关系 | |
| B. | 已知铱的一种核素是${\;}_{77}^{191}$Ir,则其核内的中子数是114 | |
| C. | ${\;}_{6}^{14}$C和${\;}_{7}^{17}$N的质量数相同,但质子数不同,所以互称为同位素 | |
| D. | 钾的原子结构示意图为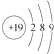 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
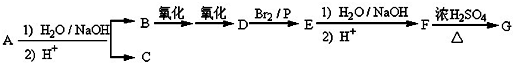

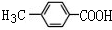 .
.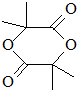 .
.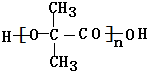 +(n-1)H2O,该反应属于缩聚反应(填反应类型).
+(n-1)H2O,该反应属于缩聚反应(填反应类型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阴极反应可表示为 2H++VO2++e-═V3++H2O | |
| B. | 阳极反应可表示为 V2+-e-═V3+ | |
| C. | 若阴极电解液体积为1L,电解前pH=1,当测得V3+的物质的量浓度为0.045mol/L时,pH变为2(不考虑反应过程中体积变化) | |
| D. | 放电过程种负极反应可表示为V3++2OH--e-═VO2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
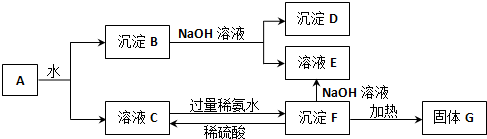
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com