
(10分)由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(其它生成物未在图中列出)
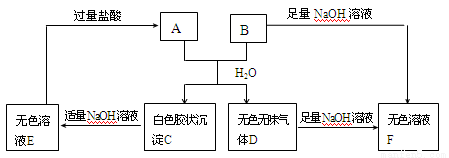
(1)无色溶液F中,一定含有的溶质的化学式为 。
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式________________。
(3)A和B的混合物溶于水发生反应的离子方程式______________________。
(4)将B与E的溶液混合时,可观察到的现象是_________________________,写出其反应的离子方程式__________________________________________。
(1)Na2CO3
(2)Al(OH)3+OH—=﹝Al(OH)4﹞—
(3)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(4)有白色胶状沉淀, ﹝Al(OH)4﹞-+HCO3-=Al(OH)3↓+CO32-+H2O
【解析】
试题分析:B的焰色反应呈黄色,说明B为钠盐,能与氢氧化钠反应,所以B为NaHCO3;F为Na2CO3;D为CO2;A与NaHCO3反应,生成白色胶状沉淀,C为Al(OH)3;所以A为AlCl3;E为Na〔Al(OH)4〕;(1)F中,一定含有的溶质的化学式为Na2CO3;(2)Al(OH)3与氢氧化钠反应的离子方程式为Al(OH)3+OH—=﹝Al(OH)4﹞—;(3)NaHCO3与AlCl3发生双水解反应,反应方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑;(4)Na〔Al(OH)4〕与NaHCO3混合,生成氢氧化铝沉淀;反应离子方程式为
﹝Al(OH)4﹞-+HCO3-=Al(OH)3↓+CO32-+H2O。
考点:本题考查铝的化合物的性质。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(16分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:选择题
滴加新制氯水后,下列各组离子还可能大量存在的是
A.Fe3+、Al3+、Cl-、NO3- B.K+、Na+、I-、SO42-
C.Ag+、Ca2+、NH4+、NO3- D.Na+、Ba2+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省英文学校高一上学期12月月考化学试卷(解析版) 题型:选择题
决定金属性强弱的是
A.1个金属原子失去电子的多少
B.1 mol金属与酸反应放出氢气的多少
C.1 mol金属失去电子的多少
D.金属原子失去电子的难易程度
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省英文学校高一上学期12月月考化学试卷(解析版) 题型:选择题
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是 ①NaHCO3 ②Al2O3③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次月考化学试卷(解析版) 题型:填空题
(5分)已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃) | |
沉淀溶解平衡 | Ksp |
| 5,0×10-13mol2·L-2 |
| 8.3×10-17mol2·L-2 |
| 6.3×10-18mol2·L-2 |
| 1.6×10-24mol2·L-2 |
| 1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺序为: 。
(2)向饱和的AgI溶液中加入固体硝酸银,则[I-] (填“增大”、“减小”或“不变”),若改加AgBr固体,则[Ag+] (填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是 (用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡:ZnS(s)  Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次月考化学试卷(解析版) 题型:选择题
下列电解质溶液的有关叙述正确的是
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)= c(HCO3-)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)= c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高一上学期第三次考试化学试卷(解析版) 题型:选择题
某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:
分析表中数据,下列说法中不正确的是

A.由①、②可知:①中的盐酸过量
B.由②、③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经反应完全
C.所用盐酸的物质的量浓度为0.4 mol·L-1
D.该混合物中NaHCO3的物质的量分数为50%
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次考试化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中,一定能大量共存的是
①c(H+)=10-12 mol·L-1的溶液中:I-、NO3-、SO32-、K+
②中性溶液中:Fe3+、NO3-、Na+、SO42-
③由水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl-
④使甲基橙变黄色的溶液中:CO32-、Na+ 、AlO2-、SO42-
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com