
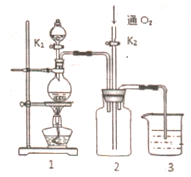
 硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)分析 (1)检验装置的气密性,应该先形成密闭体系,在根据气体热胀冷缩的原理检验.
(2)Cu与硫酸、硝酸反应生成氮的氧化物,通入氧气可以使其在氢氧化钠溶液中完全吸收;
(3)①高温灼烧固体应在坩埚中进行;
②调节溶液的PH时,不能引进杂质离子,且所加的物质可以和酸发生反应即可;向反应液中加Fe2(SO4)3时,Fe2(SO4)3与Cu反应生成FeSO4,亚铁离子被氧气氧化为铁离子;
③根据铜原子守恒得铜和五水硫酸铜的关系,求出CuSO4•5H2O 质量,然后求出产率;对比两种方案时从能量消耗、产品纯度、是否产生有害物质等分析.
解答 解:(1)检验装置的气密性,应该先形成密闭体系,则需要关闭活塞K1、K2,微热圆底烧瓶,烧瓶中气体膨胀,则3中长导管有气泡冒出,停止加热,烧瓶中气体压强减小,大气压压着水进入长导管,则长导管中形成一段水柱,
故答案为:关闭K1、K2,微热圆底烧瓶,3中长导管有气泡冒出,停止加热长导管中形成一段水柱;
(2)Cu与硫酸、硝酸反应生成氮的氧化物,氮的氧化物属于有毒气体用于氢氧化钠溶液吸收,所以3中液体为氢氧化钠溶液,通入氧气可以使氮的氧化物在氢氧化钠溶液中完全吸收,
故答案为:使生成的氮的氧化物能被完全吸收;NaOH溶液;
(3)①高温灼烧固体应在坩埚中进行,故答案为:坩埚;
②调节溶液的PH时,不能引进杂质离子,且所加的物质可以和酸发生反应即可,所以甲物质为CuO或CuCO3;向反应液中加Fe2(SO4)3时,Fe2(SO4)3与Cu反应生成FeSO4,其反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;通入的氧气能够把亚铁离子氧化为铁离子,其反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;
故答案为:ab;2Fe3++Cu=2Fe2++Cu2+、4Fe2++O2+4H+=4Fe3++2H2O;
③设3.2g铜生成五水硫酸铜的质量为xg,根据铜原子守恒得铜和五水硫酸铜的关系式为:
Cu→CuSO4•5H2O
64 250
3.2g xg
所以x=$\frac{3.2g×250}{64}$=12.5
理论上生成CuSO4•5H2O 12.5克,故产率为$\frac{10.6g}{12.5g}$×100%=84.8%,
故答案为:84%.
点评 本题考查了学生对实验原理的理解、实验方案的评价、实验装置的理解与评价、常用化学用语、物质推断、实验条件控制等,难度中等,应根据实验目的思考实验原理,根据实验原理中反应物的状态和反应条件确定试剂和装置,通过比较和评价优选最佳实验方案.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )| A. | 工作时电极b作正极,O2-由电极b流向电极a | |
| B. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| C. | 当传感器中通过2×10-3 mol电子时,通过的尾气中含有2.24 mL CO | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
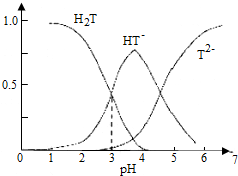
| A. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 | |
| B. | 常温下,H2T?H++HT- Ka=10-3 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2- | |
| D. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCl3+H2S═2FeCl2+2HCl+S↓ | |
| B. | 2NH4Cl+6HCl+K2Cr2O7═2KCl+N2↑+2CrCl3+7H2O | |
| C. | 3Br2+6NaOH═NaBrO3+5NaBr+3H2O | |
| D. | 5H2S+2KMnO4+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定温度下的BaSO4水溶液中,Ba2+和SO42-浓度的乘积是一个常数 | |
| B. | 向含有BaSO4固体的溶液中加入适量的水使溶解又达到平衡时,BaSO4的溶度积不变,其溶解度也不变 | |
| C. | 只有难溶电解质才存在沉淀溶解平衡过程 | |
| D. | 向饱和的BaSO4水溶液中加入硫酸,BaSO4的Ksp变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 溶液 | ①品红溶液 | ②Na2S | ③BaCl2 | ④Ba(OH)2 | ⑤Ba(NO3)2 |
| 现象 | 溶液褪色 | 黄色沉淀 | 无明显现象 | 白色沉淀 | 白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可利用铝热反应大量冶炼金属铁 | |
| B. | 金属钠、铝和铜都可用还原法制备 | |
| C. | 电解饱和氯化镁溶液可得金属镁 | |
| D. | 用足量CO还原磁铁矿得到9 mol铁时转移24 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com