

分析 (1)根据金属铝可以和酸反应生成可溶性的铝盐,该铝盐可以和过量氢氧化钠反应生成偏铝酸盐,此盐可以和二氧化碳反应;
(2)二氧化硫可以和饱和碳酸氢钠反应生成二氧化碳;
②一氧化氮不溶于水而二氧化碳能溶于水中;
(3)氯气能将亚铁离子氧化为三价铁离子;
(4)双氧水具有氧化性,能将还原性的离子碘离子、亚铁离子氧化.
解答 解:(1)金属铝可以和酸反应生成可溶性的铝盐,该铝盐可以和过量氢氧化钠反应生成偏铝酸盐,偏铝酸盐中通入二氧化碳反应可以获得氢氧化铝,故样品中不含有金属铝,
故答案为:Al;
(2)①二氧化硫可以和饱和碳酸氢钠反应生成二氧化碳,所以反应Ⅰ获得的是二氧化硫和二氧化碳的混合气体,Z是二氧化碳,即C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②二氧化氮可以和水反应生成一氧化氮气体,所以反应Ⅰ是焦炭和浓硝酸的反应,Z中两种气体是NO、CO2,故答案为:NO、CO2;
(3)Fe2O3、Fe、CuO、C均可以和浓酸反应,除了生成气体以外还有Cu2+、Fe2+、Fe3+、H+,通入过量的Cl2,并不断搅拌,充分反应后,氯气能将亚铁离子氧化为三价铁离子,过量的铁能将铜离子还原,此时存在的离子有Cu2+、Fe3+、H+,故答案为:Cu2+、Fe3+、H+;
(4)双氧水具有氧化性,能将还原性的离子碘离子、亚铁离子氧化,原理方程式为:2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2,故答案为:2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2.
点评 本题是一道物质的检验题目,可以根据物质的性质以及实验现象进行回答,以实验流程的形式考查,增加了难度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与H2O 的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径途径a比途径b放出更多热能途径途径a:C $→_{高温}^{H_{2}O}$CO+H2 $→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$ CO2 | |
| C. | FeCl3和MnO2均可 加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| D. | Mg在CO2中燃烧生成MgO和C的反应中,化学能全部转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L醋酸 | B. | 0.5L0.1mol/L氯化钠溶液 | ||
| C. | 0.1L0.1mol/L硫酸钠溶液 | D. | 2L0.1mol/L磷酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
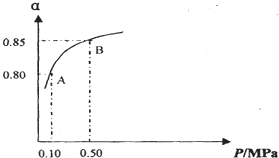
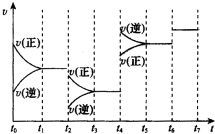
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题.
4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题. ,气体分子(MN)2的电子式:
,气体分子(MN)2的电子式: ,X形成的离子的电子式:Mg2+.
,X形成的离子的电子式:Mg2+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 |  |  |  | |
| 添加试剂 | 10.0mlFeSO4溶液 | 10.0mlFeSO4溶液+2ml煤油 | 10.0mlFeSO4溶液+1.0铁粉 | 10.0mlFeSO4溶液+ 少量(或几滴)硫酸 |
| 3天内的现象 | 溶液颜色很快变成黄色,并出现棕黄色浑浊 | / | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16 gO2中含有的氧分子数为NA | |
| B. | 1 molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2 L H2O中含有的氢原子数为NA | |
| D. | 1 mol/LBaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com