
| A. | 4a+4b+4c | B. | 2a-2b+6c | C. | 2a-2b+2c | D. | 2a-6b+2c |
分析 92g液态酒精的物质的量为$\frac{92g}{46g/mol}$=2mol,根据盖斯定律构造出目标热化学反应方程式,
①C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H1=-a kJ/mol
②C2H5OH(g)═C2H5OH(l)△H2=-b kJ/mol
③H2O(g)═H2O(l)△H3=-c kJ/mol
[①-②+③×3]得:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)反应热与化学计量数成正比,据此计算判断.
解答 解:已知:①C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H1=-a kJ/mol
②C2H5OH(g)═C2H5OH(l)△H2=-b kJ/mol
③H2O(g)═H2O(l)△H3=-c kJ/mol
由盖斯定律[①-②+③×3]得:C2 H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)则△H=-(a-b+3c)kJ•mol-1,
92g液态酒精的物质的量为$\frac{92g}{46g/mol}$=2mol,完全燃烧,最后恢复到室温,反应热与化学计量数成正比,则放出的热量(单位kJ)为2a-2b+6c,
故选B.
点评 本题考查根据盖斯定律计算反应热,题目难度不大,关键是构造目标热化学反应方程式,注意反应热的符号.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z<Y<W,而离子半径:W<Y<Z | |
| B. | 含W的盐溶液一定呈酸性 | |
| C. | 由X、Y、Z组成的盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 | |
| D. | W和Y形成的原子个数比为1:1的共价化合物,具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域,是一种原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
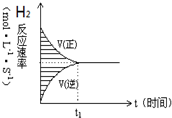 14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )
14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )| A. | 阴影部分面积表示H2物质的量浓度的减少 | |
| B. | 反应达到限度时,H2、I2、HI的物质的量浓度比一定为1:1:2 | |
| C. | 当容器中密度保持不变时,说明反应一定达到平衡状态 | |
| D. | 若0~10s内,HI的平均速率为0.01mol/(L•s),10s时H2余1.9mol,则容器体积V为2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
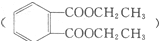 路线:
路线: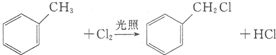
 .
.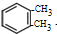 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$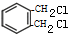 +2HCl
+2HCl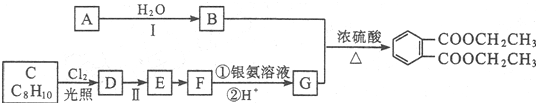
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
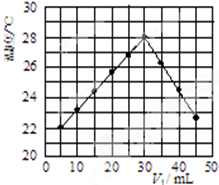 (一)实验方法测定反应热---------中和热测定
(一)实验方法测定反应热---------中和热测定| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1Cl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏是物理变化 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化主得到的是乙烯、丙烯等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
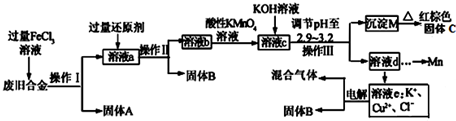
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com