
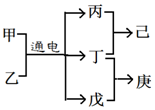
 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )| A. | 原子半径Z>Y>X | |
| B. | 仅由这四种元素构成的溶液可能呈酸性、碱性或中性 | |
| C. | 己为由极性键构成的非极性分子 | |
| D. | 戊为一元弱碱 |
分析 0.001mol•L-1的己溶液pH为3,则己为强酸,应为HCl,可知丙、丁分别为氢气、氯气,则甲、乙为饱和食盐水溶液,由转化关系可知丁为Cl2,丙为H2,戊为NaOH,庚为NaCl、NaClO的混合物,由此可知W为H、X为O、Y为Na、Z为Cl元素,以此解答该题.
解答 解:由以上分析可知W为H、X为O、Y为Na、Z为Cl,甲、乙为饱和食盐水溶液丁为Cl2,丙为H2,戊为NaOH,庚为NaCl、NaClO的混合物,己为HCl.
A.同周期元素从左到右原子半径减小,应为Na>Cl,故A错误;
B.仅由这四种元素构成的溶液,如为NaCl和HCl的混合溶液,则呈酸性,如为NaOH、NaCl的混合溶液,则呈碱性,如为NaCl的溶液,则呈中性,故B正确;
C.己为HCl,为极性分子,故C错误;
D.戊为NaOH,为强碱,故D错误;
故选B.
点评 本题考查无机物的推断,为高频考点,侧重分析与推断能力的考查,注意元素化合物知识的应用,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物为推断的突破口,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
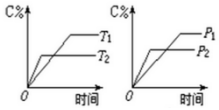 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,若升温,则K减小 | |
| B. | 达平衡后,加入催化剂C%增大 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,若增加A的量,B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2合成可降解塑料聚碳酸酯,实现“碳”的循环利用 | |
| B. | 由地沟油加工合成的“生物柴油”与柴油成分相同 | |
| C. | 高温消毒就是用加热的方法使蛋白质变性 | |
| D. | 海水提镁、炼铁、制造玻璃等工业都用到石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
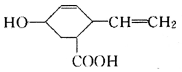
| A. | 分子式为C9H12O3,可以燃烧 | |
| B. | 能发生取代反应和聚合反应 | |
| C. | 能使酸性高锰酸钾溶液和溴的CCl4溶液褪色,褪色原理相同 | |
| D. | 分子中所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
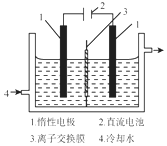 碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.| 试验方法 | 实验现象及结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com