
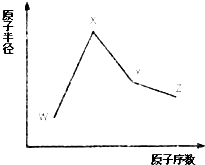
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.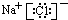 ;
;分析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,可知W的质子数为8,则W是氧元素;X和Ne原子的核外电子数相差1,且原子半径比W大,可知X为11号元素,故X为Na元素;Y的原子半径介于X和W之间,Y的单质是一种常见的半导体材料,所以Y是Si元素;Z的原子半径在同周期主族元素中最小,原子序数大于Si,故Z为Cl元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,可知W的质子数为8,则W是氧元素;X和Ne原子的核外电子数相差1,且原子半径比W大,可知X为11号元素,故X为Na元素;Y的原子半径介于X和W之间,Y的单质是一种常见的半导体材料,所以Y是Si元素;Z的原子半径在同周期主族元素中最小,原子序数大于Si,故Z为Cl元素,
(1)根据上面的分析可知,W是氧元素,W的核素符号是188O,
故答案 为:188O;
(2)X为Na元素,Z为Cl元素,用电子式表示X和Z形成的化合物为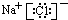 ,
,
故答案为: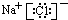 ;
;
(3)Y与W形成的化合物为二氧化硅,X的最高价氧化物的水化物为氢氧化钠,它们反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(4)X与W形成的原子个数比为1:1的化合物为过氧化钠,其中含有的化学键类型有离子键、非极性共价键,
故选:A、C;
(5)W是氧元素,W与周期表中半径最小的原子按原子个数1:1组成的常见液态化合物为双氧水,其稀溶液易被催化分解,来加快产生常见的气体为氧气,可使用的催化剂为MnO2或FeCl3,
故答案为:MnO2;FeCl3.
点评 本题考查结构性质位置关系应用,关键是根据原子半径与原子序数确定元素,难度中等,注意对基础知识的理解掌握.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
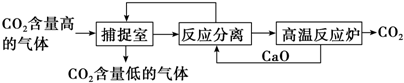
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| Sn | 231 | 227 | 加热时与Cl2反应生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 极易水解 |
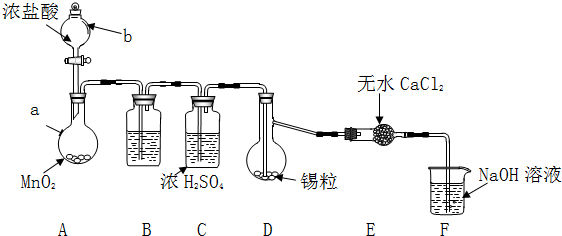
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式: | |
| B. | 镁的原子结构示意图为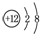 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+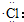 →H+[ →H+[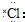 ]- ]- | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )
如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )| A. | 此电池的能量转化率未达到100% | |
| B. | 铝罐将逐渐被腐蚀,电池供电时铝罐上发生氧化反应 | |
| C. | 炭棒应与玩具电机的正极相连 | |
| D. | 电池工作一段时间后炭棒和碳粒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 9种 | C. | 12种 | D. | 14种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH,KOH,CsOH碱性依次减弱 | B. | HCl,PH3,H2S稳定性依次减弱 | ||
| C. | Na,Mg,Al还原性依次减弱 | D. | S2-,Cl-,Ca2+半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com