
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
【答案】D
【解析】
A.依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq);Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1210-12=10-12,AgCl的沉淀溶解平衡为:AgCl (s)
2Ag+(aq)+CrO42-(aq);Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1210-12=10-12,AgCl的沉淀溶解平衡为:AgCl (s)![]() Ag+(aq)+Cl-(aq);Ksp(AgCl)=c(Ag+)·c(Cl-)=10-310-7=10-10,A正确;
Ag+(aq)+Cl-(aq);Ksp(AgCl)=c(Ag+)·c(Cl-)=10-310-7=10-10,A正确;
B.在难溶化合物的溶解平衡曲线下方的点,溶液中离子浓度幂之积大于其Ksp,可以形成该物质的沉淀,在溶解平衡曲线上方的点溶液中离子浓度幂之积小于其Ksp,不可以形成该物质的沉淀,M区域在AgCl溶解曲线上方而处于Ag2CrO4沉淀下方,所以M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀,B正确;
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,形成AgCl沉淀需要Ag+的浓度c(Ag+)=![]() =10-9mol/L;形成Ag2CrO4沉淀需要Ag+的浓度c(Ag+)=
=10-9mol/L;形成Ag2CrO4沉淀需要Ag+的浓度c(Ag+)=![]() =3.162×10-6mol/L>10-9mol/L,形成AgCl沉淀需要的Ag+小,因此会先析出AgCl沉淀,C正确;
=3.162×10-6mol/L>10-9mol/L,形成AgCl沉淀需要的Ag+小,因此会先析出AgCl沉淀,C正确;
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水,其中仍然存在Ag2CrO4、AgCl的沉淀溶解平衡,温度不变,所以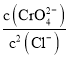 不变,D错误;
不变,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】有机物X是合成治疗癌症药物的中间体,其合成部分路径如下:
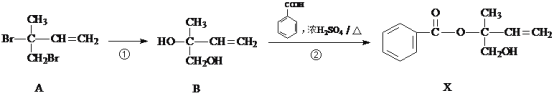
(1)反应①的反应物以及条件为________。
(2)由B制备X的过程中,有副产物C生成(与X互为同分异构体),C的结构简式为_____。
(3)下列有关X的说法正确的是________。
A.该物质属于芳香烃 B.X分子中含有一个手性碳原子
C.X可发生还原反应 D.用酸性高锰酸钾溶液可鉴别化合物X与B
(4)写出苯甲酸的一种含有苯环的同分异构体的结构简式_________。
(5)B在一定条件下发生加聚反应可得到一种高吸水性树脂,其结构简式为_________。
(6)写出X与NaOH溶液反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 是一种在药物合成中有重要作用的有机物,下列关于该有机物的说法正确的是
是一种在药物合成中有重要作用的有机物,下列关于该有机物的说法正确的是
A.该有机物在一定条件下能发生酯化反应、还原反应、氧化反应、加成反应、消去反应
B.该有机物中有4种官能团
C.1mol该有机物分别与足量的碳酸氢钠溶液、金属钠反应,产生气体的物质的量不相同
D.该有机物的分子式为C14H16O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为![]() 计算:
计算:
(1)该条件下N2的平衡转化率______;(小数点后保留一位)
(2)该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数_______。(不带单位)
N2(g)+3H2(g)的平衡常数_______。(不带单位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1mol/L的NaOH溶液,分别滴定20mL、浓度均为0.1mol/L的两种酸HX、HY。所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A.0.1mol/L的一元酸HY在水中有1%发生电离
B.a点的导电能力比b点弱
C.b点溶液中,c(HY)+2c(H+)=c(Y-)+2c(OH-)
D.加NaOH溶液至pH=7时,两种溶液中,(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,其结构简式如图所示。下列有关叙述中不正确的是( )
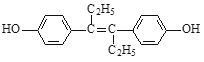
A. 己烯雌酚的分子式为C18H20O2
B. 己烯雌酚分子中一定有16个碳原子共平面
C. 己烯雌酚为芳香族化合物
D. 己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
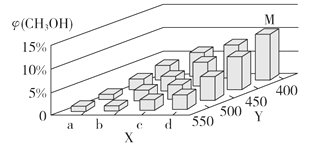
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
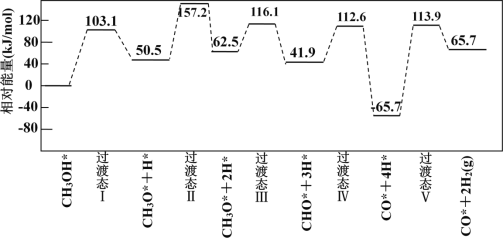
该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 探究I-与Fe2+的还原性强弱 | 向FeCl3稀溶液中依次加入KI溶液、淀粉 |
B | 探究HPO42-在水溶液中的电离程度与水解程度的相对大小 | 测定0.1 mol·L-1NaH2PO4溶液的pH |
C | 配制0.1 mol·L-1邻苯二甲酸氢钾( | 称取5.1 g邻苯二甲酸氢钾于烧杯中,加入少量蒸馏水溶解,转移至500 mL容量瓶中定容 |
D | 比较CaCO3和CaSO4的Ksp大小 | 向澄清石灰水中滴入0.1 mol·L-1Na2CO3溶液至不再有沉淀产生,再滴加0.1 mol·L-1Na2SO4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A(g)+3B(g)![]() 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
A.v(A)=0.20 mol·(L·min)-1B.v(B)=0.45 mol·(L·s)-1
C.v(C)=0.30 mol·(L·min)-1D.v(D)=0.35 mol·(L·min)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com