
【题目】“一碳化学”是指以研究分子中只含有一个碳原子的化合物(如CO、CO2、CH3OH等)为原料合成一系列化工产品的化学。
(一)工业上,在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)已知:CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol-1,根据下表:
物质 | H2(g) | CO(g) | CH3OH(l) |
燃烧热/kJ·mol-1 | -285.8 | -283.0 | -726.5 |
反应CO(g)+2H2(g)![]() CH3OH(g)的ΔH=_____ kJ·mol-1。
CH3OH(g)的ΔH=_____ kJ·mol-1。
(2)向2L恒容密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图所示。在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)与时间(t)变化总趋势图________。

(二)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
(3)控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO的产率的影响如图所示:
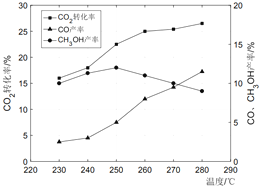
①由图可知温度升高CO产率上升,其主要原因是_____。
②由图可知获取甲醇最适宜的温度是_____。
(4)控制CO2和H2初始投料比为1:1.6,在300℃时,反应I已达到平衡状态,CO2的转化率为50%,甲醇的选择性为60%,此时容器体积为1.0L,若CO2初始加入量为2.0mol,则反应I的平衡常数是_____。
(三)以甲醇为主要原料电化学合成碳酸二甲酯[(CH3O)2CO]的反应原理如下:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O
2(CH3O)2CO+2H2O
(5)由图可知B极为电源_____(填“正”或“负”)极,阳极电极反应式是_____。

【答案】-92.9 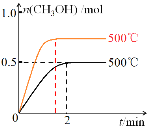 反应II为吸热反应,温度升高平衡正向移动,CO产率升高 250℃ 0.60 负 4CH3OH+2CO-4e-=2(CH3O)2CO+4H+
反应II为吸热反应,温度升高平衡正向移动,CO产率升高 250℃ 0.60 负 4CH3OH+2CO-4e-=2(CH3O)2CO+4H+
【解析】
(1)根据表中信息,①H2(g)+ ![]() O2(g)= H2O(l)ΔH=-285.8kJ/mol,②CO(g)+
O2(g)= H2O(l)ΔH=-285.8kJ/mol,②CO(g)+![]() O2(g)= CO2(g) ΔH=-283.0kJ/mol,③CH3OH(l)+
O2(g)= CO2(g) ΔH=-283.0kJ/mol,③CH3OH(l)+ ![]() O2(g)= 2H2O(l)+ CO2(g) ΔH=-726.5kJ/mol,④CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol ②+2①-③+④即可;
O2(g)= 2H2O(l)+ CO2(g) ΔH=-726.5kJ/mol,④CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol ②+2①-③+④即可;
(2)图中信息可知,在500℃时恒容的密闭容器中,反应2min时达到平衡状态;若在500℃恒压条件下,CO(g)+2H2(g)![]() CH3OH(g)反应中的气体物质的量不断减小,则相当于恒容时增大压强减小体积,则反应速率增大,达到平衡状态时的浓度增大;
CH3OH(g)反应中的气体物质的量不断减小,则相当于恒容时增大压强减小体积,则反应速率增大,达到平衡状态时的浓度增大;
(3)①CO由反应II产生,反应II为吸热反应,升高温度平衡正向移动,则CO的产率上升;
②由图可知甲醇的产率在250℃时达到最高值;
(4)若CO2初始加入量为2.0mol,控制CO2和H2初始投料比为1:1.6,则氢气初始量为3.2mol,CO2的转化率为50%,甲醇的选择性为60%,二氧化碳的反应总量为1mol,0.6mol发生反应I,0.4mol发生反应II,生成甲醇为0.6mol,水蒸汽0.6mol,消耗氢气1.8mol,反应II消耗氢气0.4mol,氢气剩余1mol;生成水蒸气0.4mol,则容器中,二氧化碳剩余1mol,氢气1mol,甲醇0.6mol,水蒸气1mol,CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g)中,此时容器为1L,则K=0.6
CH3OH(g)+ H2O(g)中,此时容器为1L,则K=0.6![]() 1/(1
1/(1![]() )=0.6;
)=0.6;
(5)B电极通入氧气生成水,则化合价由0变为-2,得电子,则为电解池的阴极,则电池B极为负极;阳极失电子生成碳酸二甲酯和氢离子,则电极反应式:4CH3OH+2CO-4e-=2(CH3O)2CO+4H+;
(1)根据表中信息,①H2(g)+ ![]() O2(g)= H2O(l)ΔH=-285.8kJ/mol,②CO(g)+
O2(g)= H2O(l)ΔH=-285.8kJ/mol,②CO(g)+![]() O2(g)= CO2(g) ΔH=-283.0kJ/mol,③CH3OH(l)+
O2(g)= CO2(g) ΔH=-283.0kJ/mol,③CH3OH(l)+ ![]() O2(g)= 2H2O(l)+ CO2(g) ΔH=-726.5kJ/mol,④CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol ②+2①-③+④即可得到ΔH=-92.9kJ/mol;
O2(g)= 2H2O(l)+ CO2(g) ΔH=-726.5kJ/mol,④CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol ②+2①-③+④即可得到ΔH=-92.9kJ/mol;
(2)图中信息可知,在500℃时恒容的密闭容器中,反应2min时达到平衡状态;若在500℃恒压条件下,CO(g)+2H2(g)![]() CH3OH(g)反应中的气体物质的量不断减小,则相当于恒容时增大压强减小体积,则反应速率增大,达到平衡状态时的浓度增大,其图像为:
CH3OH(g)反应中的气体物质的量不断减小,则相当于恒容时增大压强减小体积,则反应速率增大,达到平衡状态时的浓度增大,其图像为: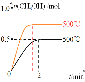 ;
;
(3)①CO由反应II产生,反应II为吸热反应,升高温度平衡正向移动,则CO的产率上升,答案为:反应II为吸热反应,温度升高平衡正向移动,CO产率升高;
②由图可知甲醇的产率在250℃时达到最高值,则最适宜的温度为250℃; (4)若CO2初始加入量为2.0mol,控制CO2和H2初始投料比为1:1.6,则氢气初始量为3.2mol,CO2的转化率为50%,甲醇的选择性为60%,二氧化碳的反应总量为1mol,0.6mol发生反应I,0.4mol发生反应II,生成甲醇为0.6mol,水蒸汽0.6mol,消耗氢气1.8mol,反应II消耗氢气0.4mol,氢气剩余1mol;生成水蒸气0.4mol,则容器中,二氧化碳剩余1mol,氢气1mol,甲醇0.6mol,水蒸气1mol,CO2(g)+3H2(g) (5)B电极通入氧气生成水,则化合价由0变为-2,得电子,则为电解池的阴极,则电池B极为负极;阳极失电子生成碳酸二甲酯和氢离子,则电极反应式:4CH3OH+2CO-4e-=2(CH3O)2CO+4H+;![]() CH3OH(g)+ H2O(g)中,此时容器为1L,则K=0.6
CH3OH(g)+ H2O(g)中,此时容器为1L,则K=0.6![]() 1/(1
1/(1![]() )=0.6;
)=0.6;


科目:高中化学 来源: 题型:
【题目】碘化钠在医学上被广泛应用于X射线造影剂、甲状腺癌防治等方面。实验室可用铁屑还原法制碘化钠。回答下列问题:
(1)向反应容器中加入30mL40%的NaOH溶液、25.4gI2,搅拌并加热,发生反应:3I2+6NaOH![]() 5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是___________,若温度过高产生的影响是______________________。
5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是___________,若温度过高产生的影响是______________________。
(2)已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。某同学设计如下方案,检验反应后溶液中存在IO3-,且c(OH-)>c(H+)限选试剂及用品:1 mol·L-1H2SO4、2 mol·L-1HNO3、淀粉KI试纸、红色石蕊试纸、蓝色石蕊试纸
实验操作 | 实验现象 | 结论 |
①用玻璃棒蘸取溶液,点在___试纸上 | 试纸呈蓝色 | c(OH-)>c(H+) |
②用玻璃棒蘸取溶液,点在___试纸上 | 试纸不变色 | |
③向实验②的试纸上滴加____溶液 | 试纸呈蓝色 | 溶液中有IO3- |
(3)向反应后的溶液中加入铁粉,产生红褐色沉淀,则该反应的离子方程式为___________。充分反应后,从混合物中获得NaI固体,首先应进行___________(填操作名称),若后续操作中直接蒸发结晶往往得不到较纯的NaI固体,可能的原因是___________。为将溶液中的NaIO3全部还原成NaI,投入铁屑的质量不少于___________g(精确到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往1.0 mol·L-1KI溶液中加入固体I2,发生反应:I2(aq)+I-(aq)![]() I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是

A. 该反应的△H>0
B. a、c两点对应的I-反应速率相等
C. b点时0~10s I-的平均反应速率为0.04mol·L-1·s-1
D. d点时该反应在对应温度下处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为 283 kJ
B.反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C.反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水可用氯气消毒,某学生用这种自来水配制下列物质的溶液,不会产生明显药品变质问题的是( )
A. AlCl3B. FeCl2C. AgNO3D. Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸有许多重要的性质,工业上可以通过硫铁矿(主要成分是FeS2)制取。
(1)硫原子核外电子占有______种能量不同的轨道。H2SO4属于______晶体。
(2)非金属性:S____O(选填“>”、“<”或“=”)。试用一个实验事实说明___________________。
(3)接触法制硫酸工业中,其主要反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)![]() 2SO3(g)+190kJ该反应的平衡常数表达式是K=_____________,该反应450℃时的平衡常数______500℃时的平衡常数(选填“大于”、“小于”或“等于”)。
2SO3(g)+190kJ该反应的平衡常数表达式是K=_____________,该反应450℃时的平衡常数______500℃时的平衡常数(选填“大于”、“小于”或“等于”)。
(4)在一个固定容积为10L的密闭容器中充入0.40mol SO2和0.20 O2,半分钟后达到平衡,测得容器中含SO3 0.36mol,则v(SO2)=____mol·![]() ·min
·min![]() ;若继续通入0.40mol SO2和0.20mol O2,则平衡______移动(选填“向正反应方向”、“向逆反应反向”或“不”)。
;若继续通入0.40mol SO2和0.20mol O2,则平衡______移动(选填“向正反应方向”、“向逆反应反向”或“不”)。
(5)该热化学方程式的意义是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:
![]()
我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如下图所示:

已知:![]()
(1)化合物A的官能团是________。
(2)反应①的反应类型是________。
(3)关于B和C,下列说法正确的是________(填字母序号)。
a.利用质谱法可以鉴别B和C
b.B可以发生氧化、取代、消去反应
c.可用酸性高锰酸钾溶液检验C中含有碳碳三键
(4)B生成C的过程中还有另一种生成物X,分子式为C3H6O,核磁共振氢谱显示只有一组峰,X的结构简式为_________。
(5)反应②的化学方程式为_________。
(6)E的结构简式为________。
(7)为了探究连接基团对聚合反应的影响,设计了单体K,其合成路线如下,写出H、I、J的结构简式:H________I_______ J________

(8)聚合物F的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究某固体化合物X(含有3种元素)的组成和性质,设计并完成如下实验,请回答:

已知:气体甲中含有两种气体(组成元素相同),且无色无味。
(1)固体X中含有氧、_________和__________三种元素(写元素符号)
(2)写出X隔绝空气分解的化学方程式___________________________________________;
(3)检验溶液A中最主要金属阳离子的方法是____________________;
(4)由沉淀转化为红棕色固体的一系列操作包括:过滤、_______、灼烧、________和称量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com