
| A. | H+、Al3+、NH4+、SO42- | B. | Ag+、NO3-、Na+、Ba2+ | ||
| C. | Fe2+、NO3-、SO42-、Na+ | D. | K+、CO32-、SO42-、OH- |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | +1价 | B. | +2价 | C. | +3价 | D. | +4价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
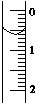 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
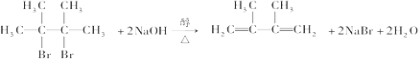 ;
;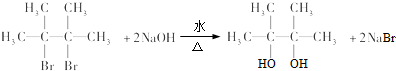 ;E与乙二醇的关系是同系物.
;E与乙二醇的关系是同系物. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Y、N的最高价氧化物中,Y、N与氧原子之间均为双键 | |
| B. | 一定条件下,Y单质能置换出N单质,M能置换出X单质 | |
| C. | N元素位于元素周期表中第3周期I V族 | |
| D. | 四种元素的原子半径:X<Y<M<N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气在工农业生产中有非常重要的应用.
氨气在工农业生产中有非常重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
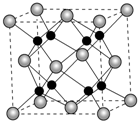 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| B. | 气体单质中一定有σ键,可能有π键 | |
| C. | 乙烯与氢气发生加成反应时,乙烯分子中有π键断裂 | |
| D. | 当原子形成分子时,首先形成σ键,可能形成π键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com