
【题目】In是第5周期ⅢA的元素;In2O3是一种透明的导电材料,可运用于触控屏、液晶显示器等高科技领域;利用水铟矿(主要成分In(OH)3),制备In2O3的工艺流程如下:
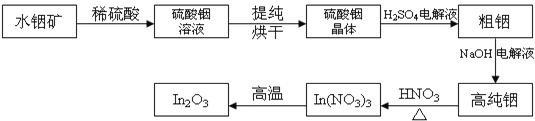
(1)写出水铟矿被硫酸酸溶的离子方程式:_____________________________。
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:___、___、过滤、洗涤和干燥。
(3)提纯粗铟的方法和铜的精炼原理相似,则粗铟为___(填“阴极”、“阳极”),写出阴极的电极反应式___________________________________。
(4)完成下列化学方程式:___In(NO3)3![]() ___In2O3+___↑+___↑。
___In2O3+___↑+___↑。
(5)高纯铟和浓硝酸反应过程中产生的NO2气体可以被Na2O2直接吸收,则标准状况下672mLNO2可以被___gNa2O2吸收。
【答案】In(OH)3+3H+=In3++3H2O 蒸发浓缩 冷却结晶 阳极 In3++3e-=In 4 2 12NO2 3O2 1.17g
【解析】
将主要成分为In(OH)3的水铟矿溶解于稀硫酸,根据酸碱中和原理得到硫酸铟的溶液,将溶液蒸发浓缩、冷却结晶、过滤并洗涤、干燥得到硫酸铟晶体,将所得晶体与稀硫酸混合后电解可得到粗铟,再用NaOH溶液为电解液,进行粗铟精炼临到高纯铟,最后将高纯铟溶解于稀硝酸,并通过加热促进硝酸铟分解可得到In2O3;
(1)根据酸碱中和原理可知固体In(OH)3溶解于稀硫酸,生成可溶性的硫酸铟和水,据此可写出此反应的离子方程式;
(2)从可溶性盐的溶液中获得溶质,通常使用的方法是蒸发结晶;
(3)粗铜精炼时粗铜作阳极,纯铜作阴极,含有铜离子的盐溶液作电解液,根据此原理选择精炼粗铟时,阴、阳极电极材料及书写电极反应式,其中阴极发生的是In3+的还原反应;
(4)硝酸盐不稳定,受热易分解,较活泼金属的硝酸盐分解产物为金属氧化物、二氧化氮及氧气,可结合电子守恒和原子守恒书写并配平此反应方程式;
(5)NO2气体可以被Na2O2直接吸收,其中NO2为还原剂,Na2O2为氧化剂,可结合电子守恒计算;NO2气体是有毒气体,不能随意排放,其对环境的主要危害有光化学烟雾和酸雨等。
将主要成分为In(OH)3的水铟矿溶解于稀硫酸,根据酸碱中和原理得到硫酸铟的溶液,将溶液蒸发浓缩、冷却结晶、过滤并洗涤、干燥得到硫酸铟晶体,将所得晶体与稀硫酸混合后电解可得到粗铟,再用NaOH溶液为电解液,进行粗铟精炼临到高纯铟,最后将高纯铟溶解于稀硝酸,并通过加热促进硝酸铟分解可得到In2O3;
(1)In(OH)3溶解于稀硫酸,发生反应的离子方程式为In(OH)3+3H+=In3++3H2O;
(2)从硫酸铟的溶液中获得硫酸铟晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤和干燥,故答案为:蒸发浓缩、冷却结晶;
(3)电解粗铟时,粗铟为阳极,阴极上In3+发生还原反应的电极反应为In3++3e-=In; (4)硝酸铟受热易分解,产物为三氧化铟、二氧化氮及氧气,根据电子守恒和原子守恒可得此反应方程式:4In(NO3)3![]() 2In2O3+12NO2↑+3O2↑,故答案为:4、2、12NO2、3O2;
2In2O3+12NO2↑+3O2↑,故答案为:4、2、12NO2、3O2;
(5)672mLNO2气体的物质的量为0.672L÷22.4L/mol=0.03mol,被nmolNa2O2直接吸收,则根据电子守恒:0.03mol×1=nmol×2,解得:n=0.015mol,Na2O2的质量为0.015mol×78g/mol=1.17g。


科目:高中化学 来源: 题型:
【题目】人体的健康有赖于体内各种元素的均衡摄入。
(1)正常人一天的食盐摄入量不超过 6g。
①除去 NaCl溶液中的SO42-,依次加入的溶液为(填溶质的化学式):过量______溶液、过量______溶液、适量稀盐酸。
②食用碘盐是食盐中加入 KIO3。下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。回答下列问题:
配料表 | 精制海盐、碘酸钾(KIO3) |
含碘量 | 20~40 mg/kg |
储藏方法 | 密封避光、防潮 |
食用方法 | 烹调时待食品熟后加入碘盐 |
食用碘盐中“碘”是指______(填“碘离子”或“碘元素”)。推测出碘酸钾(KIO3)化学性质:碘酸钾(KIO3)在高温时______(填“易分解”或“不易分解”)。一种测定含碘量的化学原理是:
(Ι)KIO3 + KI + H2SO4===K2SO4 + I2 + H2O(未配平),
(Ⅱ)I2 + 2Na2S2O3 = 2NaI + Na2S4O8。将反应 Ι 改写为离子方程式_____
(2)成人每天从食物中摄取 0.8 g Ca 元素、0.3 g Mg 元素。
①Ca 元素与 Mg 元素物质的量之比为______。
②墨鱼骨粉(主要成分是 CaCO3),可用作治疗胃酸过多,其原因是_________(用离子方程式回答)。
③从海水中可提取镁:除去混在 Mg(OH)2 中的 Ca(OH)2 的最佳方法是:加入过量的______(填“A”或“B”)(A. MgSO4 溶液 B. MgCl2 溶液),过滤,洗涤,低温烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A. 0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a Kj
D. 升高反应温度,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是

A. 该反应是放热反应
B. 加入催化剂,(b-a)的差值减小
C. 每生成2molAB分子吸收bkJ热量
D. 若反应生成AB为液态,吸收的热量小于(a-b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家近期研发出如图所示的水溶液锂离子电池体系,下列有关叙述错误的是
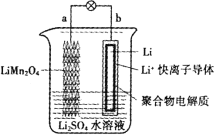
A.b电极不可用石墨替代Li
B.正极反应为:Li1-xMn2O4+xLi++xe- = LiMn2O4
C.电池总反应为:Li1-xMn2O4+xLi = LiMn2O4
D.放电时,溶液中Li+从a向b迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中国在南极建设的第四个科学考察站——泰山站。为了延长科学考察站基础设施使用寿命,钢铁设备表面镶嵌一些金属块(M)。下列说法正确的是

A. 金属块M可能是铜,发生氧化反应
B. 这种保护方法叫牺牲阳极的阴极保护法
C. 科考考察站里的设备在潮湿空气中主要发生化学腐蚀
D. 若采用外加电流的阴极保护法,设备与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧氮杂是新药研制过程中发现的一类重要活性物质,能用于改善大脑缺血。下面是某研究小组提出的一种氧氮杂类化合物E的合成路线:
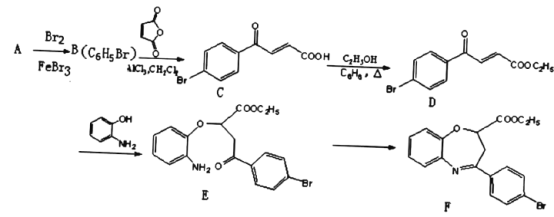
(1)A的结构简式为_____。C中官能团的名称为____。
(2)E→F经历两步反应,其反应类型依次为______、______。
(3)同时满足下列条件的D的一种同分异构体的结构简式为______。
I.分子中含有1个苯环;
II.能发生银镜反应;
III.分子中有5种不同化学环境的氢。
(4)1mol D与足量NaOH溶液反应时最多消耗_____molNaOH。
(5)由E合成F时还可能生成副产物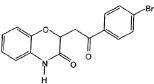 和一种常见的有机物G,G的结构简式为_______。
和一种常见的有机物G,G的结构简式为_______。
(6)已知: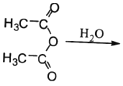 CH3COOH。原料
CH3COOH。原料![]() 俗名“马莱酐”,它是马莱酸
俗名“马莱酐”,它是马莱酸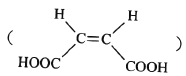 的酸酐。请写出以
的酸酐。请写出以![]() 为原料制备化合物
为原料制备化合物 的合成路线流程图(无机试剂任用)。______
的合成路线流程图(无机试剂任用)。______
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2CH2-Br
Br-CH2CH2-Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则A极的电极反应式为____________________
B极的Fe发生__________ 腐蚀(填“析氢”或“吸氧”)
(2)若开始时开关K与b连接,下列说法正确的是________(填序号)
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
且此时装置内总反应的离子方程式为________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com