
分析 根据n=$\frac{m}{M}$可知,相同质量的气体物质的量之比与摩尔质量成反比,再根据V=nVm可知,相同条件下气体体积之比等于物质的量之比;分子个数比为物质的量之比;根据相同条件下,密度之比等于摩尔质量之比.
解答 解:X、Y两种气体分子的相对分子质量分别为A、B.
同温同压下,根据n=$\frac{m}{M}$可知,同质量的X、Y气体物质的量之比=Bg/mol:Ag/mol=B:A,再根据V=nVm可知,相同条件下气体体积之比等于物质的量之比=B:A,分子个数比为物质的量之比=B:A;根据相同条件下,密度之比等于摩尔质量之比=Ag/mol:Bgmol=A:B,故答案为:B:A;B:A;A:B.
点评 本题考查物质的量的有关计算等,比较基础,注意对公式的理解与灵活应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2(SO2):澄清石灰水 | B. | CO2(CO):通入氧气,并加热 | ||
| C. | Cl2(HCl):饱和碳酸钠溶液 | D. | Fe(Al):烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
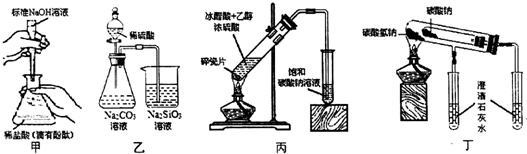
| A. | 甲装置:测定盐酸的物质的量浓度 | |
| B. | 乙装置:验证H2SO4、H2CO3、H2SiO3酸性的强弱 | |
| C. | 丙装置:实验室制备乙酸乙酯 | |
| D. | 丁装置:比较碳酸钠和碳酸氢钠的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
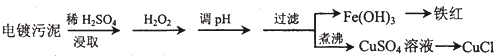
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )
对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )| A. | 实验Ⅰ:产生红褐色沉淀 | B. | 实验Ⅱ:溶液颜色变红 | ||
| C. | 实验Ⅲ:放出大量气体 | D. | 实验Ⅳ:先出现白色沉淀,后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均存在电离平衡 | B. | 阴离子数目前者大于后者 | ||
| C. | c(OH-)前者小于后者 | D. | 存在的粒子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.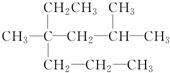 名称是2,4二甲基-4-乙基庚烷.
名称是2,4二甲基-4-乙基庚烷.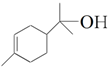 )的官能团的名称为碳碳双键、羟基.
)的官能团的名称为碳碳双键、羟基. .
. 形成六元环酯的反应
形成六元环酯的反应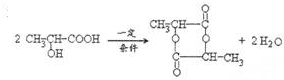 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com