



科目:高中化学 来源: 题型:
| A、浓度改变平衡必移动 |
| B、增大压强平衡必移动 |
| C、升高温度平衡必移动 |
| D、导入氦气平衡必移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
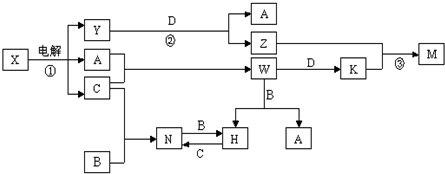
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列7种物质:
(1)下列7种物质:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 石油是工业的血液,被誉为“黑色的金子”,是重要的能源资源和化工原料.
石油是工业的血液,被誉为“黑色的金子”,是重要的能源资源和化工原料.| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用渗析法提纯胶体 |
| B、胶体、溶液和浊液这三种分散系根本区别是分散质粒子直径的大小 |
| C、胶体微粒不能透过滤纸 |
| D、往25mL沸水中逐滴加2mL FeCl3饱和溶液,可以制得Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com