
【题目】由乙烯推测丙烯(CH2=CH﹣CH3)的结构或性质正确的是( )
A.不能使酸性高锰酸钾溶液褪色
B.不能在空气中燃烧
C.能使溴水褪色
D.与HCl在一定条件下能加成只得到一种产物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E代表五种元素。A元素的三价离子3d能级处于半充满;B元素原子的最外层电子数是内层电子总数的2倍;C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体;D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子;E是短周期元素中除了稀有气体外原子半径最大的元素。试回答下列问题:
(1)写出A元素基态原子的电子排布式。
(2)B、C、D三种元素的电负性由大到小的顺序为(写元素符号)。
(3)E与C以1:1形成的物质的电子式为。
(4)用VSEPR理论判断DC3分子的空间立体结构为。
(5)元素周期表中第一电离能最大的元素是(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,已知氯化锰可溶于水,二氧化锰难溶于水,能达到实验目的的是:( )
A.用装置甲制取氯气
B.用装置乙吸收实验过程中制取的多余的氯气
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁除去氯气中的少量氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组制备氢氧化亚铁沉淀.
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
(1)实验1中产生白色沉淀的离子方程式是 .
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究: ①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物.查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3 , 方案是 .
②乙同学查阅文献:Fe(OH)2在大量SO42﹣存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐).并设计对比实验证实该假设:向试管中加入 , 再往试管中加入 , 振荡,现象与实验1相同,结论是该假设不成立.
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起.推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好.设计了如下实验方案:
试管中10mL | 滴加 | 实验现象 | |
实验2 | 6mol/L | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6mol/L | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是 , 能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是 . 丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是 , 证明该假设成立.
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为 .
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用高锰酸钾制取氧气时有如下操作步骤:①加热②检查装置的气密性③装药品④用排水集气法收集⑤从水槽中取出导气管⑥熄灭酒精灯⑦连接仪器。其中操作顺序正确的是( )
A. ①⑦③②⑤④⑥ B. ⑦②③①④⑤⑥
C. ⑤⑦③②①④⑥ D. ⑦③①②④⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱在医疗上常用于治疗青光眼,其一种合成路线如图: 
已知:Ⅰ.不饱和化合物与氨(NH3)或胺(R﹣NH2)反应能生成新的胺类化合物
如:R1﹣CH=CH2+R2﹣NH2 ![]() R1﹣CH2﹣CH2﹣NH﹣R2
R1﹣CH2﹣CH2﹣NH﹣R2
Ⅱ. ![]() +R3
+R3![]()
![]()
 +R2OH
+R2OH
(1)B中含氧官能团的名称为 .
(2)反应①的反应类型为;反应②的反应条件为 .
(3)反应③的化学方程式为 .
(4)C的结构简式为 .
(5)下列说法正确的是(填字母). a.反应④为取代反应
b.槟榔碱与化合物G互为同系物
c.1mol D最多能与2mol NaOH发生反应
(6)已知A在NaOH溶液中水解的产物之一是一种新型功能高分子材料(PAANa)的单体,写出生成PAANa的化学方程式 .
(7)已知:CH2=CHCH3+Cl2 ![]() CH2=CHCH2Cl+HCl,以丙烯和乙醇为起始原料,选用必要的无机试剂合成A,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) .
CH2=CHCH2Cl+HCl,以丙烯和乙醇为起始原料,选用必要的无机试剂合成A,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对某品牌牙膏中摩擦剂的成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。利用下图所示装置(夹持仪器略去),对该牙膏样品中碳酸钙的含量进行定量测定。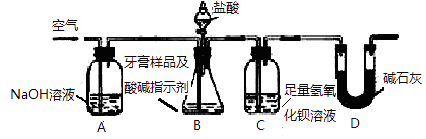
(1)C中反应生成BaCO3的化学方程式是
(2)装置D的作用是
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
(4)下列各项措施中,不能提高测定准确度的是(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A→B之间增添盛有浓硫酸的洗气装置
d.在B→C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。则样品中碳酸钙的质量分数为
(6)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)硅酸钠的水溶液俗称 , 向碳酸氢钠溶液中滴入1~2滴酚酞溶液,溶液显色。
(2)Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,产生的现象为。
(3)实验室盛装NaOH溶液的试剂瓶不能用玻璃塞,以防止发生反应:(离子方程式)。
(4)将Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无残留金属存在,请用两个化学反应方程式表示其变化:
①。
②。
(5)已知:5NH4NO3 ![]() 2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不合理的是 ( )
A.用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸等杂质
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.制备FeC13溶液时,先将固体溶于较浓盐酸,再加水稀释
D.用干燥的pH试纸测量某酸溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com