
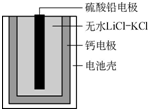
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )| A. | 该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb | |
| B. | 放电过程中,Li+向正极移动 | |
| C. | 每转移0.1mol电子,理论上生成20.7gPb | |
| D. | 常温下电解质是不导电的固体,电池不工作 |
分析 由原电池总反应可知Ca为原电池的负极,反应的电极方程式为Ca+2Cl--2e-=CaCl2,原电池的正极,发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,原电池工作时,阳离子向正极移动,阴离子向负极移动,结合电解方程式计算.
解答 解:A.由原电池总反应可知Ca为原电池的负极,反应的电极方程式为Ca+2Cl--2e-=CaCl2,原电池的正极,发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,正极和负极相机可以得到总反应,即PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb,故A正确;
B.原电池工作时,阳离子向正极移动,故B正确;
C.根据电极方程式PbSO4+2e-+2Li+=Li2SO4+Pb,可知每转移0.1 mol电子,理论上生成0.05molPb,质量为10.35g,故C错误;
D.熔融无水LiCl-KCl混合物作电解质,存在自由移动的离子,电解质是不导电的固体,无法构成原电池,故D正确.
故选C.
点评 本题考查原电池的工作原理,注意根据总反应式结合物质所含元素化合价的变化判断原电池的正负极,把握电极方程式的书写方法,易错点为D,注意把握原电池的构成条件,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 贮存能量 | |
| D. | 断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| B. | 定容时,如果加水超过了刻度线,可用蒸发皿蒸出少量水后重新定容 | |
| C. | 配制稀硫酸时,先在烧杯中加入一定量水,再沿玻璃棒慢慢加入浓硫酸 | |
| D. | 称量NaOH时,NaOH置于小烧杯中放在托盘天平左盘,砝码放在右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠 | B. | 硝酸钾 | C. | 硫酸铵 | D. | 硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: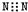 | B. | 硫原子的结构示意图: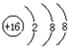 | ||
| C. | 溴化钠的电子式: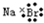 | D. | 质量数为37的氯原子${\;}_{17}^{37}$Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com