
【题目】有关①100mL 0.1 mol/L![]() 、②100mL 0.1 mol/L
、②100mL 0.1 mol/L![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
【答案】C
【解析】
A、因HCO3-的水解程度大于其电离程度,所以NaHCO3溶液显碱性;由于CO32-水解使得Na2CO3溶液也显碱性。根据越弱越水解原理可知,HCO3-的水解程度小于CO32-,弱离子水解程度越大,水的电离程度越大,所以相同浓度的NaHCO3和Na2CO3溶液中,水电离出的H+个数:②>①,A正确;
B、HCO3-水解生成H2CO3和OH-,即消耗一个HCO3-的同时又生成一个OH-,水解的过程中阴离子数不变;但CO32-的第一级水解生成HCO3-和OH-,即消耗一个CO32-的同时却生成了两个阴离子,水解的过程中,阴离子总数在增加;由于起始时CO32-和HCO3-的浓度相同,所以溶液中阴离子的物质的量浓度之和:②>①,B正确;
C、因HCO3-的水解程度大于其电离程度,所以①溶液中:c(H2CO3)>c(CO32-),C错误;
D、CO32-的第一级水解生成HCO3-,第二级水解生成H2CO3,且以第一级水解为主,所以②溶液中:c(HCO3-)>c(H2CO3),D正确;
答案选C。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种烷烃和一种烯烃组成的混合气体共10 g,混合气体的密度是相同状况下氢气密度的12.5倍,该混合气体通过Br2水时,Br2水的质量增加8.4 g,则组成该混合气体的可能是( )
A.甲烷、乙烯B.丙烷、乙烯C.乙烷、丙烯D.甲烷、丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃A中碳元素与氢元素的质量比为6︰1.淀粉在一定条件下水解可生成B。B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量。有关物质的转化关系如下图:
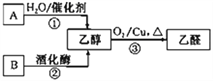
请回答:
(1)①的反应类型是_________________。
(2)向试管中加入2 mL10%氢氧化钠溶液,滴加4~5滴5%硫酸铜溶液,振荡后加入2 mL10% B溶液,加热。写出加热后观察到的现象_____________________________。
(3)反应③的化学方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼![]() 是重要的化工原料,广泛地应用于医药、农药、染料等。其在工业上常利用尿素氧化法制备,反应原理为
是重要的化工原料,广泛地应用于医药、农药、染料等。其在工业上常利用尿素氧化法制备,反应原理为![]() 。某同学在实验室模仿工业制备方法制备
。某同学在实验室模仿工业制备方法制备![]() 。回答下列问题:
。回答下列问题:
(1)![]() 溶液的制备,装置如图所示。
溶液的制备,装置如图所示。
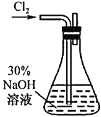
①实验室利用二氧化锰和浓盐酸制备氯气的离子方程式为_________________。
②实验需要用到![]() 的NaOH溶液,配制该溶液所需玻璃仪器除量筒外还有_____。
的NaOH溶液,配制该溶液所需玻璃仪器除量筒外还有_____。
③锥形瓶中发生反应的化学方程式为___________________________。
④因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液中NaOH的浓度。利用所提供试剂,设计实验方案:____________________________所提供的试剂有:![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 的盐酸、酚酞试液。
的盐酸、酚酞试液。
(2)水合肼的制备,装置如图所示。
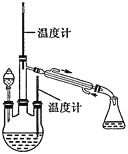
实验步骤:控制反应温度![]() 加热装置已省略
加热装置已省略![]() ,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,持续加热蒸馏三颈烧瓶内的溶液,收集
,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,持续加热蒸馏三颈烧瓶内的溶液,收集![]() 馏分于锥形瓶中。已知
馏分于锥形瓶中。已知![]() 。分液漏斗中的溶液是_________
。分液漏斗中的溶液是_________![]() 填“
填“![]() 溶液”或“NaOH和NaClO混合溶液”
溶液”或“NaOH和NaClO混合溶液”![]() ,选择的理由是___________。
,选择的理由是___________。
(3)馏分中水合肼含量的测定。
称取馏分![]() ,加入适量的
,加入适量的![]() 固体
固体![]() 滴定过程中,控制溶液的pH保持在
滴定过程中,控制溶液的pH保持在![]() 左右
左右![]() ,加水配成
,加水配成![]() 溶液,移出
溶液,移出![]() ,用
,用![]() 的
的![]() 溶液滴定。实验测得消耗
溶液滴定。实验测得消耗![]() 溶液的平均值为
溶液的平均值为![]() ,馏分中水合肼
,馏分中水合肼![]() 的质量分数为_____。
的质量分数为_____。![]() 已知:
已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等体积等物质的量浓度的盐酸和氨水溶液混合后,溶液呈_____(填“酸性”,“中性”或“碱性”),溶液中c(H+)_____ c(OH—)+c(NH3·H2O)(填“>”或“=”或“<”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)=_______mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=__________mol/L,由水电离产生的c(H+)=_______mol/L,此时温度_______25℃(填“高于”、“低于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)≒bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质B的质量分数减小了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,甲乙两组同学分别设计了如图一、图二所示的实验。
(1)可通过观察图一的现象:_______________,而定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是_____________,你认为还可以作何改进?____________________。
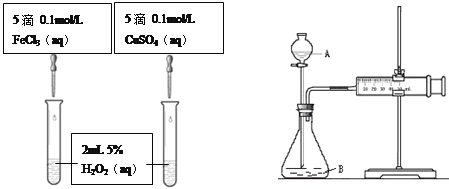
图一 图二
(2)检查图二装置气密性的方法是_______________________。图二所示实验中需测量的数据是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:下列说法错误的是
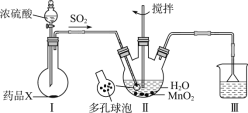
A.装置I烧瓶中放入的药品X为Na2SO3
B.装置II中用“多孔球泡”可增大SO2的吸收速率
C.装置Ⅲ烧杯中溶液为饱和NaHSO3
D.用装置II反应后的溶液制备MnSO4H2O需经历蒸发浓缩、冷却结晶、过滤洗涤干燥等过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com