
| A. | △H>0的反应一定不能自发进行 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | |
| C. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| D. | 在5NH4NO3=2HNO3+4N2↑+9H2O中,生成28gN2时转移的电子数目为3.75mol |
分析 A.反应自发进行的判断依据是△H-T△S<0;
B.醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,根据n=C×V比较二者的体积关系;
C.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,前者为盐析,后者为蛋白质变性;
D.5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,转移15mol电子时生成4mol氮气.
解答 解:A.化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发,所以焓变和熵变都不能独立地作为反应自发性的判据,故A错误;
B.醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,设盐酸的浓度为C1,醋酸的浓度为C2,则C1<C2,
分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,则有:n=C1V1=C2V2,因C1<C2,
所以:V1>V2,消耗盐酸的体积更大,故B错误;
C.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,饱和Na2SO4溶液降低蛋白质溶解度,为盐析现象,为可逆过程,再加入水可以溶解,硝酸具有强氧化性,使蛋白质变性,过程不可能,二者原理不同,故C正确;
D.5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,转移15mol电子时生成4mol氮气,故当生成28g氮气时物质的量为1mol氮气时,转移3.75mol电子即转移的电子数目3.75NA个,故D错误.
故选C.
点评 本题侧重对化学反应原理考查,涉及反应自发性判断、蛋白质的性质、反应速率影响因素、氧化还原反应电子转移数的计算等,注意C选项中蛋白质变性的一些方法,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S水解的离子方程式:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 石墨晶体中只有共价键,不存在其他的作用力 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水滴石穿”是溶解了CO2的雨水与CaCO3的长期作用,生成了可溶性的Ca(HCO3)2 | |
| B. | 新型水处理剂高铁酸钠(Na2FeO4),因为具有强氧化性,所以能对水进行消毒,同时,还原产物能形成带电的氢氧化铁胶体,能使水中的杂质沉降而达到净水的目的 | |
| C. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可以缓解白色污染 | |
| D. | 如果人觉察到室内煤气浓度较高的时候,应该将头尽量贴地,匍匐行进至门口或者窗口,不要急着打开电灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
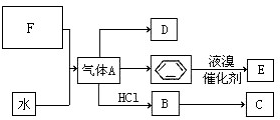 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: ;C的结构简式
;C的结构简式 ;
; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应;
+HBr,其反应类型为取代反应; ,其反应类型为加聚反应.
,其反应类型为加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
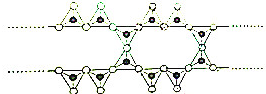 在结构中,
在结构中,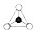 表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.
表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下用广范pH试纸测得某氯水的pH=4 | |
| B. | 酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次 | |
| C. | 若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高 | |
| D. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com