
下列仪器中,实验时仪器的下端必须插入液面下的是 ( )
A.分馏石油时的温度计
B.制备氢气的简易装置中的长颈漏斗
C.制备氯气装置中的分液漏斗
D.制备乙酸乙酯时冷凝蒸气的导管
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:阅读理解
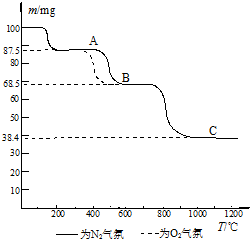
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A、冷却至室温后,在250mL容量瓶中定容配成250mL稀硫酸。
B、用某仪器量取25.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C、将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D、将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL。
E、小心滴入NaOH标准溶液,边滴边摇动锥形瓶,滴定至恰好反应为止,记下读数为V2mL。
F、把锥形瓶移到碱式滴定管下,在锥形瓶下垫一张白纸。
G、用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
就此实验操作完成下列填空:
⑴正确操作步骤的顺序(用编号字母填写) → A → → →→ → 。
⑵用来量取10.00mL浓硫酸的仪器是 。用NaOH溶液润洗碱式滴定管的目的是 。
⑶滴定中可选用的指示剂是 。滴定中,目光应注视_____;判断滴定恰好完成的依据是____;读数时,目光与凹液面的最低处保持水平。
⑷某学生实验时用稀硫酸润洗了锥形瓶测定的浓度会偏_。(填“偏高”、“偏低”、“无影响”)
⑸该浓硫酸样品的浓度计算式为 ___________ 。
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江哈尔滨第十二中学高二上学期期末考试化学试卷(解析版) 题型:实验题
为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在250mL容量瓶中定容配成250mL稀硫酸。
B.用某仪器量取25.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL。
E.小心滴入NaOH标准溶液,边滴边摇动锥形瓶,滴定至恰好反应为止,记下读数为V2mL。
F.把锥形瓶移到碱式滴定管下,在锥形瓶下垫一张白纸。
G.用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
请完成下列填空:
⑴正确操作步骤的顺序(用编号字母填写) 。
⑵用来量取10.00mL浓硫酸的仪器是 ,用NaOH溶液润洗碱式滴定管的目的是 。
⑶滴定中可选用的指示剂是 ,滴定中,目光应注视___ __ 。
⑷某学生实验时用稀硫酸润洗了锥形瓶测定的浓度会偏_ 。(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源:2013届陕西省西安市高二上学期期末考试化学(理)试卷 题型:计算题
为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A、冷却至室温后,在250mL容量瓶中定容配成250mL稀硫酸。
B、用某仪器量取25.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C、将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D、将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL。
E、小心滴入NaOH标准溶液,边滴边摇动锥形瓶,滴定至恰好反应为止,记下读数为V2mL。
F、把锥形瓶移到碱式滴定管下,在锥形瓶下垫一张白纸。
G、用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
就此实验操作完成下列填空:
⑴正确操作步骤的顺序(用编号字母填写) → A → → → → → 。
⑵用来量取10.00mL浓硫酸的仪器是 。用NaOH溶液润洗碱式滴定管的目的是 。
⑶滴定中可选用的指示剂是 。滴定中,目光应注视_____ ;判断滴定恰好完成的依据是____;读数时,目光与凹液面的最低处保持水平。
⑷某学生实验时用稀硫酸润洗了锥形瓶测定的浓度会偏_。(填“偏高”、“偏低”、“无影响”)
⑸该浓硫酸样品的浓度计算式为 ___________ 。
查看答案和解析>>
科目:高中化学 来源:09-10学年郑口中学下学期高二期末考试化学卷 题型:实验题
(12分)实验室用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液进行反应,通过测定反应过程中的放热来计算中和热。试回答下列问题:
(1)在本实验中除了用到大烧杯、小烧杯、温度计、量筒等仪器外,还须的一种玻璃仪 器名为 。
(2)两只烧杯间要填满碎纸条,其目的是 ;
(3)大烧杯上必须盖上硬纸板,否则,求得的中和热数值将 (填“偏大”、“偏小”、“无影响”)。
(4)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容C=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H= 。
(5)实验中改用52mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”)简述理由
(6)用相同浓度和体积的氨水代替烧碱溶液进行上述实验,测得的中和热的数值会 ;若改用50mL 0.50mol/L烧碱溶液进行上述实验,测得的中和热的数值会 。(填“偏大”、“偏小”、“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com