



 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源:不详 题型:多选题
| A.由题目可知,Cu2+可以大量存在于pH=4的溶液中 |
| B.可用浓硫酸代替H2O2 |
| C.未加H2O2前的硫酸铜溶液pH<4 |
| D.调节溶液pH=4可选择的试剂是氢氧化铜或氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 乙醇(水) | 新制生石灰 | 蒸馏 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.盐酸 | B.氨水 | C.烧碱溶液 | D.KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤ | B.②⑤①③④ | C.①③⑤②④ | D.②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.实验室用溴水和苯在催化剂作用下制溴苯: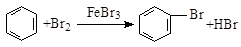 |
| B.工业上用H2冶炼金属钠:Na2O+H2△2Na+H2O |
| C.向溴乙烷中滴加AgNO3检验其中的溴原子:Ag++Br—=AgBr↓ |
| D.用氢氟酸雕刻玻璃:SiO2+4HF=SiF4↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com