
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | (NH4)2SO4 | NaHCO3 | Si | Fe2O3 |
| 用途 | 化肥 | 干燥剂 | 光电池 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,向0.1mol•L -1的醋酸溶液中加入醋酸钠晶体,若混合液的pH=7,则该溶液中c(Na+)>c(CH3COO-) | |||||||||||
| B. | 根据下表中有关共价键的键能:
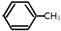 (g)+3H2(g)→ (g)+3H2(g)→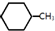 (g)的△H=-348kJ•mol-1 (g)的△H=-348kJ•mol-1 | |||||||||||
| C. | 一定量的复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,在某一时刻,反应的离子方程式可能是2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |||||||||||
| D. | 已知:25°C,Ksp(BaSO4)=1×10-10,向该温度下的饱和BaSO4溶液中加入一定量的硫酸钠或氯化钡固体后使Ksp(BaSO4)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向浓度为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| B | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未水解 |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈红色 | 原溶液中不含K+ |
| D | 某盐溶于盐酸,产生无色无味气体通入澄清石灰水 | 变浑浊 | 说明该盐是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | 氢化物稳定性:Y>Z | |
| C. | WY3中只有离子键没有共价键 | |
| D. | X与Z可形成l0电子分子和18电子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42-和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时消耗5.6LO2,转移电子为1mol | |
| B. | 检测时,电解质溶液中的H+向负极移动 | |
| C. | 正极上发生的反应为:O2+4e-+2H2O=4OH- | |
| D. | 负极上发生的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 装置 | 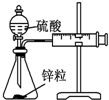 | 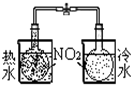 | 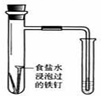 | 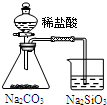 |
| 实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:简答题
研究CO2与CH4反应转化为CO和H2,对减缓燃料危机、减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=___kJ·mol-1。
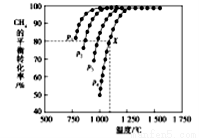
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
①下列事实能说明该反应一定达到平衡的是____。
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位______,理由是____。
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压*物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com