
| A. | 酯化反应、硝化反应以及酯的水解均属于取代反应类型 | |
| B. | 乙醇生成溴乙烷和乙烯生成溴乙烷的反应类型相同 | |
| C. | 可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸和乙醇 | |
| D. | 甲烷、苯都属于烃,都不存在同分异构体 |
分析 A.酯化反应中羧酸中-OH或醇中H被取代,硝化反应中H被硝基取代,酯的水解中-COOC-中C-O键断裂被取代;
B.乙醇生成溴乙烷时-OH被-Br取代,乙烯生成溴乙烷时碳碳双键断裂;
C.乙酸乙酯在NaOH溶液中水解;
D.甲烷、苯均只含C、H元素,苯存在同分异构体.
解答 解:A.酯化反应中羧酸中-OH或醇中H被取代,硝化反应中H被硝基取代,酯的水解中-COOC-中C-O键断裂被取代,均为取代反应,故A正确;
B.乙醇生成溴乙烷时-OH被-Br取代,乙烯生成溴乙烷时碳碳双键断裂,分别为取代反应、加成反应,故B错误;
C.乙酸乙酯在NaOH溶液中水解,不能除杂,应选饱和碳酸钠液除去乙酸乙酯中混有的乙酸和乙醇,故C错误;
D.甲烷、苯都属于烃,甲烷不存在同分异构体,但苯存在同分异构体,如CH≡C-CH2-CH2-C≡CH、CH3-C≡C-C≡C-CH3、CH2═CH-CH═CH-C≡CH等,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团、反应类型、混合物分离提纯等为解答的关键,综合性较强,题目难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
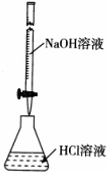
| A. | 根据图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 | |
| B. | 250℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中c(X+)一定大于c(A 3+ ) | |
| C. | 每个Fe(OH)3胶体粒子含一个氢氧化铁分子 | |
| D. | 某溶液中存在K+?HCO3-?CO32-?OH-?H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO2-3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 试剂、用品 | 预期现象 | |
| 甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
| 乙 | 溴水 | 溴水褪色 |
| 丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
 、该物质中的化学键为离子键、共价键.
、该物质中的化学键为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
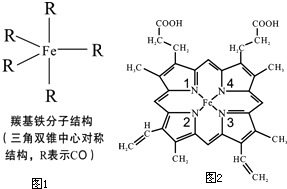 Fe、C、N、O、H可以组成多种物质.回答以下问题:
Fe、C、N、O、H可以组成多种物质.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com