
| A. | HCl→H2 | B. | Mg→Mg2+ | C. | Cl-→AgCl | D. | CuO→Cu |
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{\;}^{37}$Cl2的摩尔质量是74 | |
| B. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| C. | 35克的${\;}_{\;}^{35}$Cl2含有电子17mol | |
| D. | 常温下,4.48L ${\;}_{\;}^{37}$Cl2含有8NA 个中子(NA 为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
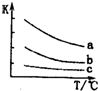 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.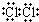 .新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)
.新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 ⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )
⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )| A. | ①③④⑥⑧ | B. | ②④⑥⑦⑨ | C. | ②③⑤⑦⑧ | D. | ①③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与NaOH溶液的反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 | |
| D. | 碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3C≡CCH3 | B. | CH2=CH2 | C. | CH≡CCH3 | D. | CH2=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钠的化合物在生产生活中应用广泛.
钠的化合物在生产生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中转移3个电子 | B. | Fe2O3发生还原反应 | ||
| C. | CO被还原 | D. | CO为氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com