
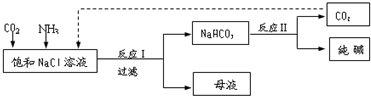
分析 (1)根据制纯碱的原理可知反应Ⅰ的化学方程式;
(2)①根据流程可知,母液中含有氯化铵,加入石灰乳后可以生成氨气,;
②根据氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来分析,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,加入细小的食盐颗粒,增大氯离子的浓度,可得到NH4Cl晶体;
(3)温度越低,NaHCO3的溶解度越小,降低NaHCO3的溶解度,使之更易析出,然后过滤、洗涤、灼烧;
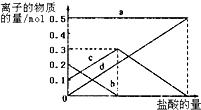
(4)混合物是碳酸钠和碳酸氢钠,滴入盐酸发生反应CO32-+H+=HCO3-;HCO3-+H+=CO2↑+H2O;依据图象分析碳酸根离子减小,碳酸氢根离子增多.
解答 解:(1)根据制纯碱的原理可知反应Ⅰ的化学方程式为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,故答案为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(2)①根据流程可知,母液中含有氯化铵,加入石灰乳后可以生成氨气,方程式为2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;NH3;
②根据氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来分析,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,加入细小的食盐颗粒,增大氯离子的浓度,可得到NH4Cl晶体,故答案为:通入NH3,加入细小的食盐颗粒;
(3)NaHCO3的溶解度随着温度的降低而减小,故用冷水可以使溶液冷却,降低NaHCO3的溶解度,使之更易析出,然后过滤、洗涤、灼烧,
故答案为:冷却,使NaHCO3晶体析出;过滤;
(4)若在(3)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,发生反应 CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;溶液中有关离子的物质的量的变化为:碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,在此过程中,Na+不参与反应,物质的量一直不变,故a曲线表示的是Na+浓度的变化;所以c曲线表示的是碳酸氢根离子物质的量变化;碳酸根离子物质的量0.2mol;碳酸氢根离子物质的量为0.1mol,故答案为:HCO3-;0.1;0.2.
点评 本题考查了工业制纯碱的原理分析,生产过程中的物质变化,混合物成分的分析判断和计算应用,实验过程分析,除杂操作,尾气吸收,图象定量分析判断,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| 实验操作 | 实现现象 | 结论 | |
| A | 用饱和碳酸钠溶液浸泡锅炉沉积物后,过滤,洗涤,在所得沉淀物中再加入稀盐酸 | 有气泡产生 | 可除去锅炉沉淀物中的CaSO4 |
| B | 某充满NO2的密闭容器中,待反应平衡后,保持温度不变,扩大容器体积 | 气体颜色变浅 | 平衡2NO2(g)?N2O4(g)正向移动 |
| C | 向品红溶液中通入某气体 | 溶液褪色 | 该气体是SO2 |
| D | 用洁净铂丝蘸取溶液置于酒精灯火焰上灼烧 | 火焰呈黄色 | 溶液中含Na+,无K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
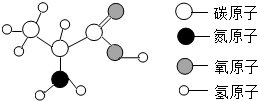 蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )
蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )| A. | 它是由四种元素组成的有机高分子化合物 | |
| B. | 每个丙氨酸分子中含有13个原子核 | |
| C. | 丙氨酸分子中含有3个碳原子 | |
| D. | 丙氨酸分子中氮、氧元素的质量比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
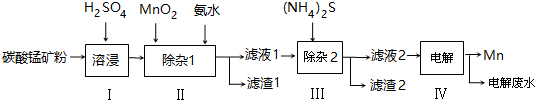
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com