
黑火药的爆炸反应为2KNO3+S+3C===K2S+N2↑+3CO2↑,其中被还原的元素是( )
A.N B.C C.N和S D.N和C
科目:高中化学 来源: 题型:
家庭厨房实际上就是一个化学世界,柴、米、油、盐、酱、醋、糖等都属于化学物质。请回答:
(1)加碘食盐所含的碘酸钾(KIO3)中,碘元素的化合价是________价。
(2)白糖与红糖的主要成分都是蔗糖。利用活性炭的____________,可将红糖脱色变成白糖。
(3)食醋不慎滴在大理石台面上,会使其表面变得粗糙而失去光泽。这是因为食醋中的________与大理石发生了化学反应。
(4)东部城市部分家庭厨房中的“柴”将被“西气东输”工程送来的“天然气”所替代,请写出天然气主要成分的化学式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
微波是一种高频电磁振荡波,“微波炉”就是利用高频电磁振荡使食品中分子也产生振荡而发热。现代医学上使用微波手术刀进行外科手术,其好处主要是使开刀处的血液迅速凝固而减少失血,关于其作用原理的说法正确的是( )
A.微波电流迅速中和血液胶粒所带的电荷而聚沉
B.微波使局部血液受热而使血液胶体聚沉
C.微波电流通过金属手术刀时产生的高温使血液聚沉
D.以上说法都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
当航天飞机返回地球进入大气层时,由于与空气的剧烈摩擦,航天飞机尖端的温度可达1 000℃以上。为了防止较高的温度将其烧毁,科学家给航天飞机的相应部位设计安装了可靠的保护层。制作保护层的材料可能是( )
A.合成塑料 B.合成纤维
C.镁铝合金 D.新型陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:
超细氮化铝粉末被广泛应用于大规模集成电路生产等领域,其制取原理为Al2O3+N2+3C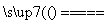 2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质,为测定该产品中有关成分的含量,进行了以下两个实验。
2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质,为测定该产品中有关成分的含量,进行了以下两个实验。
(1)称取10.00 g产品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成Na[Al(OH)4],并放出氨气3.36 L(标准状况)。
①上述反应的化学方程式为______________________________________________;
②计算该样品中AlN的质量分数。
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g·L-1(已折算成标准状况,AlN不跟O2反应)。计算该样品中含杂质炭的质量。
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,既是化合反应,又是氧化还原反应的是( )
①铁和氯气反应:2Fe+3Cl2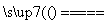 2FeCl3
2FeCl3
②氯气通入溴化钠溶液:Cl2+2NaBr===2NaCl+Br2
③氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)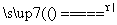 Na2SO4+2HCl↑
Na2SO4+2HCl↑
④二氧化锰跟浓盐酸在加热条件下反应:
MnO2+4HCl(浓)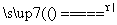 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑤氢气在氯气中燃烧:H2+Cl2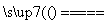 2HCl
2HCl
A.①② B.①③ C.①④ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
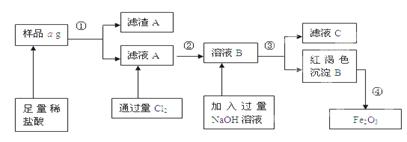
(1)滤液C中溶质含有_ ▲ _ (写化学式);
(2)如何验证滤液A中含Fe2+,而不含Fe3+:___ ▲ __ ___。
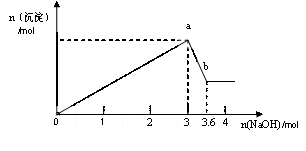
(3)现有溶液B 100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如下图。
①a点对应的沉淀为 ▲ (填化学式)。
②计算原混合液中FeCl3和AlCl3的物质的量浓度为多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.090 nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.130 | 0.118 | 0.102 | 0.099 | 0.073 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)。
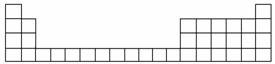
(2)A元素处于周期表中第________周期________族。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com