
| A. | 钠原子失去一个电子后,它的电子数与氖原子相同,所以变成氖原子 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
分析 A、钠失去一个电子成为钠离子,和氖原子不同;
B、氢元素的一种原子:氕,是不含有中子的原子;
C、根据核素、元素、同位素的概念和内涵进行解答;
D、同位素是质子数形同,而中子数不同的同种元素的不同原子之间的互称.
解答 解:A、钠失去一个电子成为钠离子,它的电子数与氖原子相同均使10,但是钠离子绝不是氖原子,故A错误;
B、氕是不含有中子的原子,故B错误;
C、核素是指具有一定数目质子和一定数目中子的一种原子,具有相同质子数,不同中子数同一元素的不同原子互为同位素,核素间互称同位素,元素是质子数(即核电荷数)相同的一类原子的总称,元素包含同位素,故C正确;
D、同位素是质子数形同,而中子数不同的同种元素的不同原子之间的互称,4018Ar、4019K、4020Ca的质量数相同,不能说明质子数和中子数之间的关系,故D错误,
故选C.
点评 本题主要考查了有关的化学概念,深入理解各种概念的含义是解答这类题的关键,注意把握电子排布规律,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 22.4L的二氧化硫气体中含有的氧原子数为2NA | |
| C. | 1.0L 1.0mol•L-1CH3COOH溶液中含有的CH3COOH分子数为NA | |
| D. | 1 mol OH-离子中含有的质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g) | B. | NH3(g)+HCl(g)═NH4Cl(s) | ||
| C. | 4Al(s)+3O2(g)═2Al2O3(s) | D. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过澄清石灰水 | |
| B. | 先通过碳酸氢钠溶液,再通过澄清石灰水 | |
| C. | 通过品红溶液 | |
| D. | 先通过足量的溴水,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氯气含有的分之数为0.5NA | |
| B. | 常温常压下,1mol氮气含有的质子数为7NA | |
| C. | 在标准状态下,22.4LH2O含有的原子数目为3NA | |
| D. | 32gO2所含原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
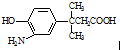 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质有7种不同环境的氢原子 | |
| C. | 该物质遇FeCl3溶液显色,1mol该物质最多能与含1mol Br2的溴水发生取代反应 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
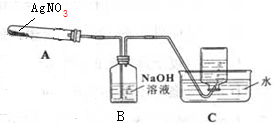
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | - | 除尽Ag+ |
| (2)取少量上述溶液于试管中加入KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上述溶液于试管中,加入酸性KMnO4溶液,振荡 | 紫色消失 | 存在Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com