
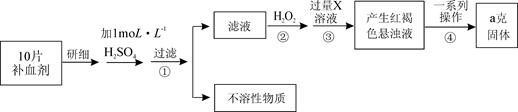
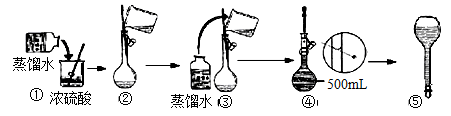
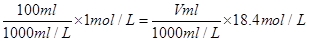 ,V=5.4 ml
,V=5.4 ml

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源:不详 题型:填空题

 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.55 |
| 2 | 20.00 | 6.00 | 25.95 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.①② | B.③④ | C.①③ | D.②④ |
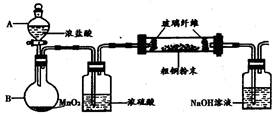
 NaCl+N2↑+2H2O实验装置如图所示,试回答:
NaCl+N2↑+2H2O实验装置如图所示,试回答: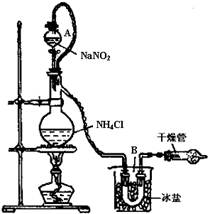
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
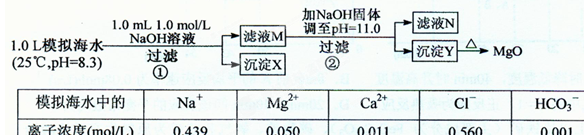
| A.沉淀物X为CaCO3 |
| B.滤液M中存在Mg2+,不存在Ca2+ |
| C.滤液N中存在Mg2+、Ca2+ |
| D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com