
分析 (1)安全气囊内的NaH发生化学反应生成金属钠与氢气,反应方程式为:2NaH═2Na+H2↑,一种物质转化为两种物质;
(2)根据n=$\frac{m}{M}$,计算96gNaH的物质的量;
(3)根据方程式计算生成氮气的物质的量,再根据V=nVm计算氮气的体积.
解答 解:(1)安全气囊内的NaH发生化学反应生成金属钠与氢气,反应方程式为2NaH═2Na+H2↑,一种物质转化为两种物质,所以是分解反应,
故答案为:2NaH═2Na+H2↑;分解反应;
(2)96gNaH的物质的量=$\frac{96}{24}$=4mol,故答案为:4mol;
(3)96g NaH完全分解,设生成氢气的物质的量为n,则:
2NaH═2Na+H2↑,
2 1
4mol n
n=2mol
故标况下生成氮气的体积=2mol×22.4L/mol=44.8L,
故答案为:44.8L.
点评 本题考查物质的量计算、化学方程式计算,比较基础,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.5 mol | D. | 0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO:0.06mol•L-1 | B. | H2O:0.002mol•L-1 | ||
| C. | NH3:0.002mol•L-1 | D. | O2:0.00125mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙
乙 丙
丙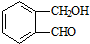

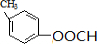
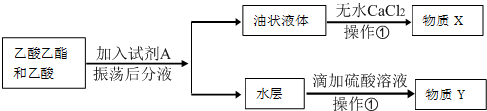
 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
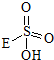 →
→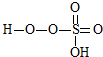 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 最外层电子数为7的原子,最高正价为+7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com