
 4CO(g) + SrS(s) △H=+a kJ·mol-1
4CO(g) + SrS(s) △H=+a kJ·mol-1  2CO2(g) + SrS(s) △H=+b kJ·mol-1
2CO2(g) + SrS(s) △H=+b kJ·mol-1 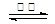 2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。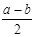 (2分) ②2SrS+2H2O
(2分) ②2SrS+2H2O Sr(OH)2+Sr(HS)2(3分)
Sr(OH)2+Sr(HS)2(3分) 4CO(g) + SrS(s)和SrSO4(s) + 2C(s)
4CO(g) + SrS(s)和SrSO4(s) + 2C(s) 2CO2(g) + SrS(s)相减即得到2C(s) + 2CO2(g)
2CO2(g) + SrS(s)相减即得到2C(s) + 2CO2(g)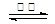 4CO(g),所以C(s) + CO2(g)
4CO(g),所以C(s) + CO2(g)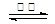 2CO(g)的△H=
2CO(g)的△H=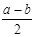 kJ·mol-1。
kJ·mol-1。 Sr(OH)2+Sr(HS)2。
Sr(OH)2+Sr(HS)2。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.氯、溴、碘 | B.钠、镁、铝 |
| C.烧碱、氢气 | D.食盐、淡水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
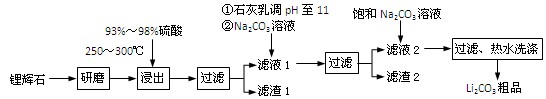
 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
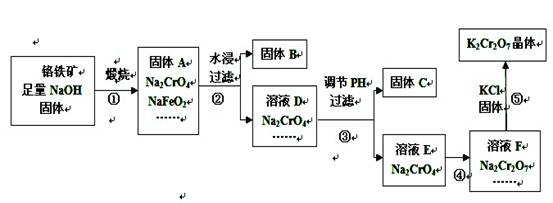
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com