
分析 A元素可形成自然界硬度最大的单质,该单质为金刚石,则A为C元素;B的2p半满,则2p轨道上有三个未成对电子,则B为N元素;根据X原子的第一电离能至第四电离可知,X原子的第四电离能剧增,则X表现+3价,所以X为Al元素;Y与X同周期,是该周期电负性最强的元素,则Y为Cl元素;Z的一种同位素的质量数为53,中子数为29,则质子数=53-29=24,故Z为Cr元素,以此来解答.
解答 解:A元素可形成自然界硬度最大的单质,该单质为金刚石,则A为C元素;B的2p半满,则2p轨道上有三个未成对电子,则B为N元素;根据X原子的第一电离能至第四电离可知,X原子的第四电离能剧增,则X表现+3价,所以X为Al元素;Y与X同周期,是该周期电负性最强的元素,则Y为Cl元素;Z的一种同位素的质量数为53,中子数为29,则质子数=53-29=24,故Z为Cr元素,
(1)Z为24号Cr元素,根据构造原理,其基态原子核外电子排布式为1s22s2 3S23p63d54s1,故答案为:1s22s2 3S23p63d54s1;
(2)非金属性越强,电负性越强,Al、O、N元素的电负性与非金属性一致,则三种元素电负性大到小顺序为O>N>Al,故答案为:O>N>Al;
(3)AY4的化学式是CCl4,与甲烷结构相似,为正四面体结构,属于非极性分子,A2H4分子含4个C-H、1个碳碳双键,σ键与π键的个数比为5:4,
故答案为:非极性分子;5:4;
(4)X的氧化物与NaOH溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的性质、原子结构、元素化合物知识推断元素为解答的关键,侧重分析与推断能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下含有NA个氦原子的氦气的体积约为11.2L | |
| B. | 1 L 0.1 mol/LNaHSO4溶液中含有0.1NA个HSO4- | |
| C. | 标准状况下,22.4 L CCl4所含的分子数约为NA | |
| D. | CO和N2组成的42g混合气体中原子的个数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①
Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①查看答案和解析>>
科目:高中化学 来源: 题型:解答题
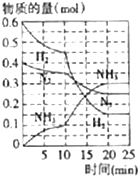 氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:
氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com