
【题目】将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O = SO42+4H++2Fe2+,Cr2O72+6Fe2++14H+ = 2Cr3++6Fe3++7H2O。下列说法正确的是( )
A.还原性:Cr3+>Fe2+>SO2B.氧化性:Cr2O72>Fe3+>SO2
C.Cr2O72不能将SO2氧化D.两个反应中Fe2(SO4)3均作还原剂
【答案】B
【解析】
反应SO2+2Fe3++2H2O = ![]() +4H++2Fe2+中SO2是还原剂、Fe3+是氧化剂、Fe2+是还原产物、SO42-是氧化产物,反应
+4H++2Fe2+中SO2是还原剂、Fe3+是氧化剂、Fe2+是还原产物、SO42-是氧化产物,反应![]() +6Fe2++14H+= 2Cr3++6Fe3++7H2O中Fe2+是还原剂、
+6Fe2++14H+= 2Cr3++6Fe3++7H2O中Fe2+是还原剂、![]() 是氧化剂、Fe3+是氧化产物、Cr3+是还原产物,
是氧化剂、Fe3+是氧化产物、Cr3+是还原产物,
A. 根据同一反应中还原剂的还原性大于还原产物的还原性得出,还原性:SO2>Fe2+>Cr3+,故A错误;
B. 根据同一反应中氧化剂的氧化性大于氧化产物的氧化性得出,氧化性:![]() >Fe3+,在反应SO2+2Fe3++2H2O =
>Fe3+,在反应SO2+2Fe3++2H2O = ![]() +4H++2Fe2+中SO2是还原剂、Fe3+是氧化剂,因此氧化性:
+4H++2Fe2+中SO2是还原剂、Fe3+是氧化剂,因此氧化性:![]() >Fe3+>SO2,故B正确;
>Fe3+>SO2,故B正确;
C. 根据A项分析和反应![]() +6Fe2++14H+= 2Cr3++6Fe3++7H2O,结合氧化还原反应中“强制弱”规律,因此
+6Fe2++14H+= 2Cr3++6Fe3++7H2O,结合氧化还原反应中“强制弱”规律,因此![]() 能将SO2氧化为SO42,故C错误;
能将SO2氧化为SO42,故C错误;
D. 第一个反应中Fe2(SO4)3作氧化剂,第2个反应中Fe2(SO4)3是氧化产物,故D错误;
综上所述,答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72 L CH4;②3.01×1023个HCl分子;③7.2 g H2O,下列对这三种物质的关系从小到大的排列顺序是:
(1)物质的量______;
(2)体积______;
(3)质量______;
(4)氢原子数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL溴乙烷,振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。

(1)用水浴加热而不直接用酒精灯加热的原因是_________;试管口安装一长导管的作用是________________________。
(2)观察到________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是_____________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是________________,检验的方法是______________________________说明所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 用氢氧化钠溶液吸收过量二氧化碳气体:CO2 +OH-=HCO3-
C. 制备氢氧化铁胶体:Fe3++3OH--Fe(OH)3↓
D. 醋酸除去水垢:2H+ +CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍具有良好的导磁性和可塑性,主要用于制作合金及催化剂。请回答下列问题
(1)基态镍原子的价电子排布图为____,同周期元素中基态原子与镍具有相同未成对电子的还有____种。
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为___三种组成元素按电负性由大到小的顺序为____。
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为____,写出与SO42-互为等电子体的一种分子和一种离子的化学式____,____;[Ni(
NH3)4]SO4中H-N-H键之间的夹角___(填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角。
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的____体空隙中,其空隙的填充率为____。
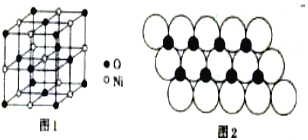
(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为___g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组设计利用废旧干电池中的锌皮和未知浓度的稀盐酸制取纯净、干燥的氢气,并验证气体中是否含有杂质。实验装置图如图:
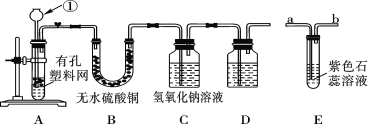
(1)装置A中仪器①的名称是_____;写出发生反应的离子反应方程式:_____。
(2)装置B中无水硫酸铜的作用是___。为了检验气体中还可能存在的杂质,可将E装置连接到上述装置___(填序号)之间。
(3)D装置中的试剂是_______(写出名称)。
(4)下列收集氢气的方法中符合题意的是_____。
A.排水法 B.向下排空气法 C.干瘪的塑料袋 D.塑料瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1
B. X、Y的转化率不相等
C. 平衡时,Y和Z的生成速率之比为2∶3
D. c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol·L-1,试计算:(写出简单的计算过程)
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol·L-1,试计算:(写出简单的计算过程)
(1)x的值为多少________
(2)B的转化率为多少________
(3)平衡时A的浓度为多少________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com