
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | ─ | ─ | 4.7 | ─ |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
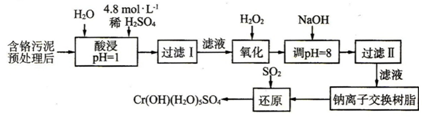
分析 Ⅰ(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;
(2)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质;
硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(3)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写;
(4)钠离子交换树脂交换的离子是钙离子和镁离子;
Ⅱ用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,生成的亚铁离子与Cr2O72-发生氧化还原反应被还原为Cr3+然后生成Cr(OH)3沉淀除去.
解答 解:Ⅰ:(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;
故答案为:250mL容量瓶、胶头滴管;
(2)双氧水有强氧化性,能氧化还原性的物质,Fe2+和Cr3+有还原性,Fe2+和Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离;
硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离;Fe3+和Al3+;
(3)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平,2Na2CrO4+3SO2+12H2O=2CrOH(H2O)5SO4↓+Na2SO4,
故答案为:1,3,11H2O,2,1;
(4)钠离子交换树脂交换的离子是钙离子和镁离子.
故答案为:Ca2+、Mg2+;
Ⅱ:Fe为阳极,则阳极反应为Fe-2e-=Fe2+,溶液中氢离子在阴极放电生成氢气,则阴极反应为2H++2e-=H2 ↑,产生的阳极产物在处理废水中的铬元素中所起的作用,生成的亚铁离子与Cr2O72-发生氧化还原反应被还原为Cr3+,是作还原剂将+6价的Cr还原为+3价的Cr.
故答案为:Fe-2e-=Fe2+;2H++2e-=H2 ↑;做还原剂,将+6价的Cr还原为+3价的Cr.
点评 本题考查溶液配制、化学方程式的配平、物质的分离、电解原理及氧化还原反应,难度较大,注意会运用溶液的pH值对溶液中的离子进行分离,熟悉发生的电极反应及氧化还原反应即可解答.


科目:高中化学 来源: 题型:选择题
| A. | x+y>3 | |
| B. | 反应速率加快,活化分子百分数增加 | |
| C. | A的转化率减小,体积分数增大 | |
| D. | 平衡正向移动,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
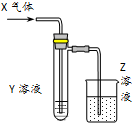 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )| X | Y | Z | 结论 | |
| A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
| B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
| C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
| D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA | |
| C. | 常温常压下,18g水含有的分子数为 NA | |
| D. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 滤纸的 颜色 变化 | 玻璃片(Ⅰ) 上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
| 玻璃片(Ⅱ) 上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com