
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
| Kw |
| c(H+) |
| 10-14 |
| 10-9 |


科目:高中化学 来源: 题型:
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Fe | Fe | NaOH溶液 | BaCl2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
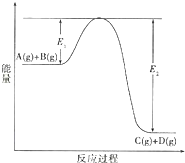 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
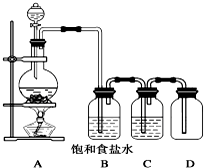 用下列装置制取并收集纯净的氯气,试回答下列问题:
用下列装置制取并收集纯净的氯气,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温度下,CuS的溶解度大于FeS的溶解度 |
| B、同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小 |
| C、向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS |
| D、除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
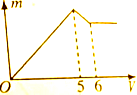 向Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液时,其沉淀的质量m和所加NaOH体积V之间的关系如图所示,则混合液中Al2(SO4)3与MgSO4的物质的量之比是( )
向Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液时,其沉淀的质量m和所加NaOH体积V之间的关系如图所示,则混合液中Al2(SO4)3与MgSO4的物质的量之比是( )| A、1:1 | B、1:2 |
| C、2:1 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分解反应一定是氧化还原反应 |
| B、非金属单质在氧化还原反应中一定作氧化剂 |
| C、氧化剂具有氧化性,还原剂具有还原性 |
| D、氧化剂在氧化还原反应中被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com