
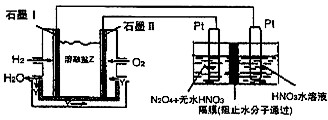
 Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是______;Y和X组成元素相同,Y与水反应生成M,足量M的浓溶液与3.2g Cu在加热条件下充分反应,其中被还原的M的物质的量为______.固态Z可应用于人工降雨,0.5mol?L-1Z与NaOH反应所得的正盐水溶液中,离子浓度从大到小的顺序为______.
Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是______;Y和X组成元素相同,Y与水反应生成M,足量M的浓溶液与3.2g Cu在加热条件下充分反应,其中被还原的M的物质的量为______.固态Z可应用于人工降雨,0.5mol?L-1Z与NaOH反应所得的正盐水溶液中,离子浓度从大到小的顺序为______.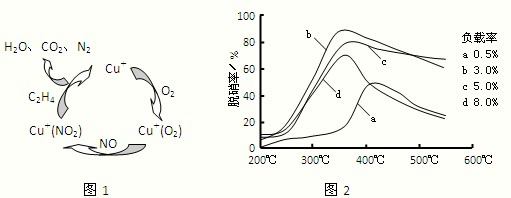
 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O, 3N2+4CO2+4H2O,
3N2+4CO2+4H2O, 3N2+4CO2+4H2O;;
3N2+4CO2+4H2O;;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
查看答案和解析>>
科目:高中化学 来源:2012届福建省高二下学期期中考试化学试卷 题型:选择题
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2—与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
查看答案和解析>>
科目:高中化学 来源:2010年高考试题--化学(海南卷)解析版 题型:多选题
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com